Lucía Escobar Ropero1, Tristán Gascón Marchal2, Jesús Manuel Aznar Aznar3, Laura Navarro Combalía4, Marta Borobia Frías5, Araceli Loste Montoya6
1Estudiante de doctorado Programa Medicina y Sanidad Animal, Universidad de Zaragoza; Veterinaria Generalista, Hospital Veterinario Valvet Unavets, Zaragoza
2Graduado en Veterinaria, Universidad de Zaragoza
3Técnico superior veterinario en medicina interna, Hospital Veterinario de la Universidad de Zaragoza
4Profesora asociada. Doctora en Veterinaria. Departamento de Patología Animal. Facultad de Veterinaria, Universidad de Zaragoza
5Profesora contratada doctora. Departamento de Patología Animal. Facultad de Veterinaria, Universidad de Zaragoza
6Profesora titular. Departamento de Patología Animal. Facultad de Veterinaria, Universidad de Zaragoza
Imágenes cedidas por los autores
La diabetes mellitus (DM) es una de las endocrinopatías más prevalentes en la especie canina, ocasionada por una deficiencia absoluta o relativa en la producción endógena de insulina1. Su diagnóstico se basa en la sintomatología clínica del animal: poliuria, polidipsia, polifagia y pérdida de peso, junto con un estado de hiperglucemia y glucosuria crónica (tabla 1).
| Tabla 1. Fisiopatogenia y cuadro clínico de la diabetes mellitus canina2,3 | |
| Cuadro clínico | Fisiopatogenia |
| Poliuria (PU) y polidipsia (PD) | En los pacientes con diabetes mellitus, la glucemia supera el umbral renal de reabsorción (180-200 mg/dl), lo que provoca glucosuria y subsecuente diuresis osmótica. Esto da lugar a la aparición de PU y ocasiona una PD secundaria. Se considera PU cuando la producción de orina es > 50 ml/kg al día, y PD cuando la ingesta de agua es > 100 ml/kg al día. En la práctica la poliuria es difícil de valorar, por lo que se utiliza un refractómetro para medir la densidad urinaria; valores inferiores a 1.030 podrían indicar una pérdida de la capacidad estenúrica renal, sospechando de una PU/PD. |
| Polifagia | La insulina está implicada en la actividad del centro de la saciedad a nivel del hipotálamo. Los animales con niveles insuficientes de esta hormona presentan frecuentemente polifagia. |
| Pérdida de peso | La falta relativa o absoluta de insulina impide que la glucosa entre al interior de las células de la mayor parte de los tejidos del organismo. Es por ello que, a través de la movilización de grasas y proteínas, se instaura una ruta alternativa para realizar la gluconeogénesis a nivel hepático. Esto puede ocasionar una posible hiperlipidemia, lipidosis hepática y atrofia muscular en los pacientes que padecen la enfermedad. |
Debido a su carácter crónico, la diabetes mellitus canina precisa de una monitorización continua por parte del veterinario clínico, y una participación activa del propietario del animal. El manejo terapéutico de esta enfermedad endocrina se centra en controlar los signos clínicos y evitar la aparición de complicaciones graves como la hipoglucemia o la cetoacidosis diabética4. Con frecuencia, la presencia de comorbilidades complica el manejo terapéutico de estos pacientes y representa un desafío considerable para el clínico. Por ello, el presente artículo se centra en el manejo terapéutico de perros diabéticos que padecen simultáneamente síndrome de Cushing (SC) o enfermedad renal crónica.
Manejo de la diabetes mellitus canina secundaria al síndrome de Cushing
El síndrome de Cushing es una de las endocrinopatías más comunes en la especie canina, caracterizada por un estado de hipercortisolismo crónico, cuyo origen puede ser endógeno (ACTH-dependiente o hipofisario, ACTH-independiente o adrenal) o secundario a la administración exógena de glucocorticoides (síndrome de Cushing iatrogénico)5.
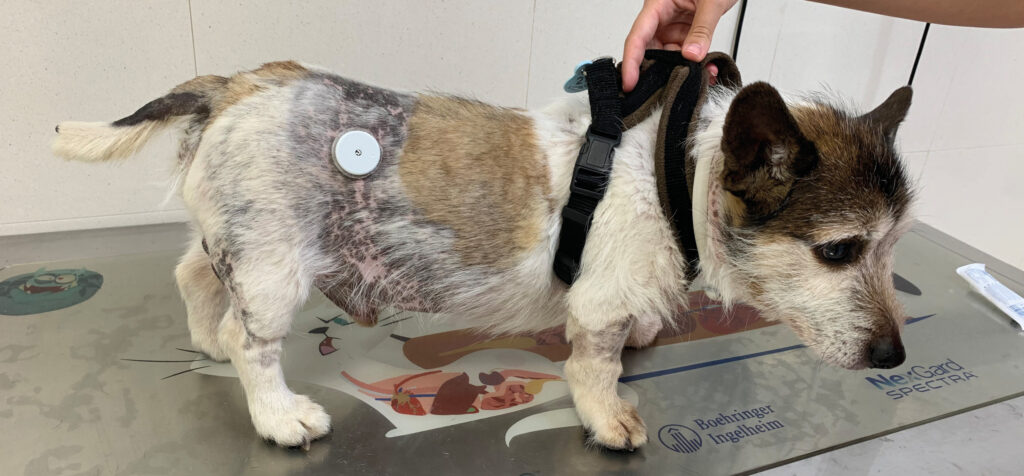
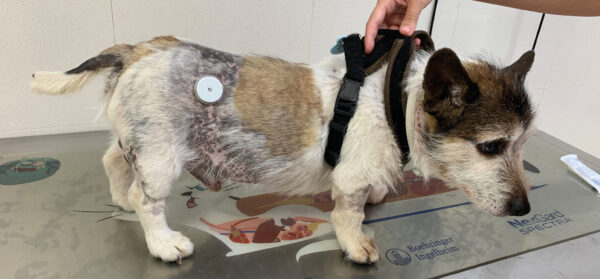
La sintomatología más común asociada a esta patología incluye poliuria, polidipsia, polifagia, alopecia simétrica y bilateral, abdomen péndulo, jadeo y atrofia muscular (imagen 1). Los signos clínicos guardan, por tanto, una estrecha similitud con los descritos en la diabetes mellitus. Por el momento, no existe una única prueba de diagnóstico endocrino que se considere gold standard, por lo que en la mayoría de los casos será necesario realizar la prueba de estimulación con ACTH y/o la prueba de supresión con dexametasona con dosis bajas. Existe una evidencia clara de la presentación simultánea del síndrome de Cushing y la diabetes mellitus en la especie canina5.
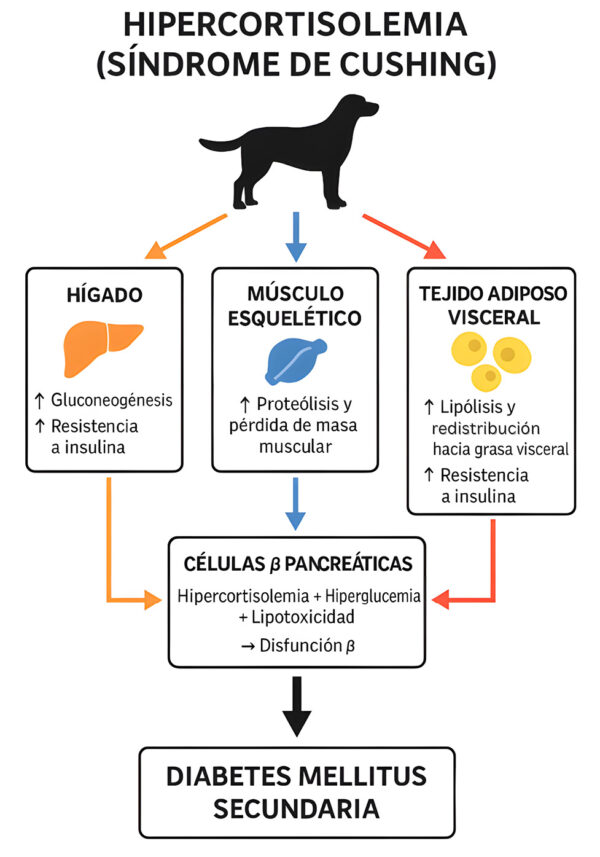
Fisiopatogenia
En perros con síndrome de Cushing, se ha observado que el exceso crónico de glucocorticoides genera con frecuencia una hiperglucemia leve-moderada. Como resultado, un porcentaje de estos pacientes acaban desarrollando diabetes mellitus mediante diversos mecanismos. La magnitud de la hipercortisolemia y las diferencias individuales en la sensibilidad tisular a los glucocorticoides parecen ser determinantes en dicha progresión6,7.
A nivel hepático, el exceso de glucocorticoides activa la gluconeogénesis e induce una resistencia a la acción de la insulina que limita el efecto inhibidor de esta hormona sobre la producción hepática de glucosa. En el músculo, incrementa la proteólisis y la pérdida de masa muscular, deteriorando la captación periférica de glucosa. A nivel del tejido adiposo, induce lipólisis y redistribución hacia la grasa visceral, incrementando la resistencia a la insulina. La combinación de hipercortisolemia, hiperglucemia y lipotoxicidad deteriora progresivamente las células β pancreáticas, predisponiendo a una diabetes mellitus secundaria cuyo manejo terapéutico reside en controlar el síndrome de Cushing y restaurar la sensibilidad a la insulina (imagen 2).6
Aunque es menos frecuente, en algunos perros puede desarrollarse en primer lugar la diabetes mellitus y posteriormente el síndrome de Cushing.
secundaria al síndrome de Cushing.
Manejo conjunto de ambas endocrinopatías
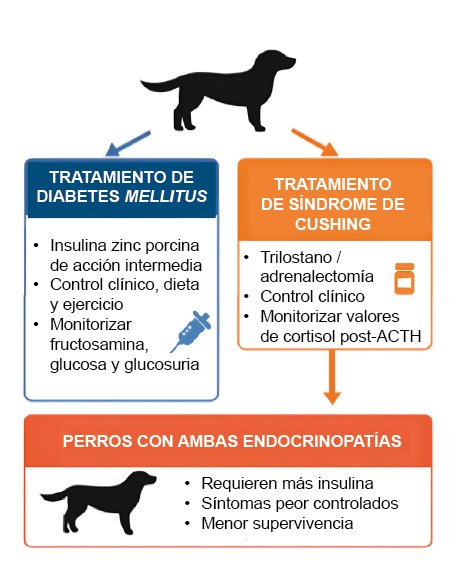
El tratamiento de elección para la diabetes mellitus en perros es una insulina porcina de acción intermedia, que se presenta como una mezcla del 65 % de insulina-zinc en forma cristalina (de acción prolongada) y del 35 % en forma amorfa (de acción rápida), independientemente de que presenten otra endocrinopatía concomitante. Esta debe ser administrada vía subcutánea dos veces al día, comenzando con una dosis de 0,25-0,5 UI/kg, con el objetivo de conseguir un control óptimo de la enfermedad y reducir el riesgo de aparición de hipoglucemias. Este abordaje debe complementarse con un buen control dietético (acorde a la condición corporal del paciente) y una actividad física constante8. La efectividad del tratamiento se ve reflejada en la mejoría de los síntomas clínicos que se valora mediante un cuestionario (cuadro 1)9, y a nivel laboratorial, en una disminución de la concentración de fructosamina, la glucemia y la glucosuria8.
| Cuadro 1. Cuestionario ALIVE Diabetic’s Clinical Score9. | |
| Signos clínicos | Puntuación |
| 1. Pérdida de peso 0= No ha perdido peso o ha ganado desde el último control 1= Leve (< 5 % de pérdida) 2= Moderado (5‐10 % de pérdida) 3= Grave (> 10 % de pérdida) |
|
| 2. Poliuria-polidipsia 0= Normal 1= Leve (algún incremento observado por el propietario) 2= Moderado (tiene que llenar más veces el bebedero) 3= Grave (está continuamente bebiendo) |
|
| 3. Apetito 0= Normal o disminuido (si está disminuido excluir CAD o enfermedad concurrente) 1= Leve polifagia (termina la comida con voracidad) 2= Moderada polifagia (come con voracidad y pide más) 3= Grave polifagia (tiene obsesión por la comida) |
|
| 4. Actitud/Actividad 0= Normal 1= Leve disminución (ligeramente menos activo) 2= Moderada disminución (sin duda está menos activo) 3= Grave disminución (está mucho tiempo tumbado). Considerar CAD |
|
| PUNTUACIÓN TOTAL | |
| Interpretación: Intervalo de puntuación: 0‐12Objetivo del tratamiento: conseguir la puntuación más baja sin que se produzca hipoglucemia CAD: cetoacidosis diabética |
|
CUESTIONARIO: ALIVE CUSHING’S CLINICAL SCORE
Por su parte, el manejo del síndrome de Cushing en la mayoría de los casos se realiza de forma médica con tratamiento farmacológico; el trilostano es el principio activo de elección en nuestro país. Este es un inhibidor competitivo de la 3β-hidroxiesteroide deshidrogenasa, cuyo efecto clínico óptimo se alcanza, en muchos casos, con una dosificación aproximada de 1 mg/kg/12 h vía oral, posología habitualmente inferior a la indicada en la ficha técnica5. También existe la posibilidad de realizar un tratamiento quirúrgico, hipofisectomía (poco frecuente) o adrenalectomía (tratamiento de elección ante una masa adrenal), u otras opciones terapéuticas más novedosas como la radiofrecuencia ecoguiada en aquellas masas que no invaden la vena cava y los tejidos subyacentes. No obstante, muchos propietarios descartan estas opciones debido a los riesgos anestésicos y quirúrgicos, junto con el coste económico5.
La monitorización del tratamiento en este caso se basa en la mejora de los signos clínicos, para lo cual se recomienda también utilizar el cuestionario descargable mediante el QR9,10, y en la medición de los valores de cortisol posestimulación con ACTH.
En el caso de los perros con ambas endocrinopatías, un estudio retrospectivo reciente de Pérez-López et al. (2023), en el que se incluyeron 95 perros (47 SC, 31 DM, 17 SC + DM), mostró una prevalencia de diabetes mellitus secundaria al síndrome de Cushing entre el 8 % y el 16 % de los casos, en consonancia con estudios previos11. Los autores concluyeron que los pacientes que padecían ambas endocrinopatías requerían dosis mayores de insulina, incluso cercanas a valores de insulinorresistencia12, y presentaban un control más deficiente de los principales síntomas clínicos: poliuria, polidipsia y polifagia11. En cambio, la dosis final de trilostano no difirió entre los grupos, lo que indica que la coexistencia de ambas enfermedades no obliga a intensificar la terapia supresora de cortisol. Además, la concurrencia de SC y DM se asoció a una menor supervivencia frente a los perros que padecen únicamente DM, lo que plantea un reto clínico adicional a la hora de estabilizar a estos pacientes11.
En conclusión, los perros que padecen simultáneamente ambas endocrinopatías (SC y DM) precisan un seguimiento clínico estrecho, especialmente en las fases iniciales, para ajustar la dosis de insulina y trilostano. Ambas patologías presentan un carácter crónico, por lo que el éxito radica en alcanzar la dosis terapéutica más baja efectiva, para controlar la sintomatología clínica y minimizar la aparición de complicaciones secundarias. Para ello, es fundamental una monitorización periódica y un protocolo individualizado según las necesidades de cada animal.
Manejo de la diabetes mellitus y la enfermedad renal crónica en perros
La nefropatía diabética es una de las principales causas de enfermedad renal terminal en medicina humana y está estrechamente ligada al creciente aumento de diabetes mellitus tipo 2 asociada a la obesidad, lo que constituye en la actualidad un problema de salud pública13.
Por el contrario, en la especie canina la enfermedad renal crónica (ERC) suele presentar un origen multifactorial, condicionado por diversos factores predisponentes, tales como la edad avanzada y las alteraciones genéticas o hereditarias, en ocasiones relacionadas con la raza, y por factores precipitantes como la hipertensión arterial, la exposición a agentes nefrotóxicos o la presencia de infecciones. Todas estas etiologías coinciden en una destrucción progresiva e irreversible de las nefronas, habitualmente mediada por un proceso de fibrosis intersticial progresiva correlacionada con una disminución en la tasa de filtración glomerular. En este caso, no existe una evidencia sólida que vincule el desarrollo de la enfermedad renal crónica con la diabetes mellitus, si bien es cierto que en medicina humana existen factores predisponentes que correlacionan ambas patologías y que podrían extrapolarse a la especie canina14,15 (tabla 2).
| Tabla 2. Factores predisponentes para el desarrollo de la enfermedad renal crónica en personas con diabetes mellitus14. | ||
| Factor predisponente | Fisiopatogenia | Repercusión a nivel renal |
| Hiperglucemia crónica | Debido a los niveles elevados de glucemia, aumenta la reabsorción de glucosa-Na⁺ por el trasportador SGLT2 que se encuentra a nivel de los túbulos proximales renales. Su función es reabsorber la glucosa filtrada por los riñones y devolverla al torrente sanguíneo. Fármacos veterinarios como la velagliflozina actúan inhibiendo el transportador SGLT2. | Hiperfiltración, hipertensión intraglomerular e hipertrofia túbulo-glomerular. |
| Lipotoxicidad y estadoproinflamatorio crónico | La diabetes mellitus produce un aumento de los marcadores inflamatorios a nivel sanguíneo como la proteína C reactiva, las citoquinas proinflamatorias, etc. Además, en los pacientes donde hay una obesidad concomitante, la lipotoxicidad promueve el acúmulo de lípidos a nivel de las células y los túbulos renales. | Pérdida de podocitos y otras células renales debido al acúmulo de lípidos. Repercusión directa sobre la filtración glomerular. Esta alteración se manifiesta clínicamente con la presencia de proteinuria temprana, debido a que los podocitos actúan de barrera selectiva impidiendo la filtración de proteínas plasmáticas y otras macromoléculas esenciales hacia el filtrado urinario. |
| Desequilibrios hídricos | Uno de los principales síntomas clínicos de la diabetes mellitus es la poliuria. Y una de las complicaciones más frecuentes la cetoacidosis diabética, que da lugar a un desequilibrio hídrico grave consecuencia de la acidificación de la sangre por la producción de cetonas. | Propician la hipovolemia y la hipoperfusión renal aguda en casos de cetoacidosis diabética de urgencia. |
| Infecciones del tracto urinario | La presencia de glucosuria favorece la aparición de infecciones bacterianas secundarias. Asimismo, la bacteriuria subclínica presenta una prevalencia moderada. | Consecuencias renales mínimas, ya que la mayoría afectan al tracto urinario inferior. Se debe evitar el uso de tratamientos antimicrobianos de manera indiscriminada. |
Manejo conjunto de ambas patologías
El abordaje del paciente canino que presenta diabetes mellitus y enfermedad renal crónica requiere un enfoque integrado. Principalmente se centra en el control de tres pilares: la hiperglucemia, la hipertensión sistémica secundaria y el manejo dietético.
Dentro de los tres pilares nombrados anteriormente, la insulinoterapia resulta fundamental. El objetivo no radica en alcanzar niveles de normoglucemia constantes, sino en controlar la sintomatología clínica y evitar el desarrollo de complicaciones, reduciendo, la mayor parte del tiempo, la concentración de glucosa sanguínea hasta valores inferiores al umbral renal (180-200 mg/dl)4. Esto se debe a que, como se ha comentado anteriormente, en los casos donde no hay un control adecuado de la diabetes mellitus, la hiperglucemia persistente podría estar asociada a la aparición de hipertensión intraglomerular, fibrosis y esclerosis de las nefronas, favoreciendo el desarrollo de enfermedad renal crónica.
Se estima que un alto porcentaje de los perros con ERC desarrollan hipertensión sistémica, consecuencia del sobrestímulo del eje renina angiotensina aldosterona (SRAA), que aparece como un mecanismo secundario compensatorio para aumentar la tasa de filtración glomerular, que se ve disminuida conforme se va perdiendo tejido renal funcional. Además, también se produce hipertensión intraglomerular y proteinuria, lo que promueve la fibrosis y esclerosis de las nefronas y la progresión de la enfermedad renal; por ello, en estos pacientes, es muy importante tratar y monitorizar estas complicaciones. Para ello, utilizaremos fármacos que inhiban el SRAA, como los inhibidores de la enzima convertidora de angiotensina (IECA) y los antagonistas de los receptores de la angiotensina II (ARA II), cuyo efecto principal es el de inducir una vasodilatación de la arteriola eferente en el glomérulo disminuyendo la hipertensión en el mismo y, por tanto, la proteinuria16. En el perro, los fármacos del grupo ARA II, como el telmisartán, parecen tener mayor efecto sobre la PAS que los IECA, por lo que podrían ser más útiles en aquellos casos en los que tengamos hipertensión sistémica asociada a proteinuria17. Cuando la hipertensión es grave (presión arterial sistólica (PAS) >200 mmHg) suele ser necesario introducir fármacos bloqueantes de los canales de calcio, como el amlodipino, que se puede utilizar solo o en combinación con los fármacos anteriores, para un mejor control de la PAS16. La monitorización de estos pacientes debe ser estrecha y siempre siguiendo las recomendaciones de la Sociedad Internacional de Interés Renal (IRIS)18.
Como último pilar, el control dietético es imprescindible. El objetivo es alcanzar una condición corporal óptima, ya que la lipotoxicidad incrementa la resistencia a la insulina y daña las células renales que desempeñan un papel clave en el proceso de filtración renal. Además, en la coexistencia de ambas patologías se debe priorizar el establecimiento de una dieta renal. Esta presenta una restricción proteica moderada y una reducción de sodio, con el fin de preservar la funcionalidad renal.
En conclusión, en la especie canina no hay evidencias claras que relacionen el desarrollo de la enfermedad renal crónica con la diabetes mellitus, si bien es frecuente la presentación conjunta de ambas patologías. Sin embargo, en medicina humana la nefropatía diabética ocasiona un alto porcentaje de casos de enfermedad renal terminal. Los factores predisponentes que vinculan ambas patologías podrían extrapolarse a la especie canina, lo que da lugar a una línea de investigación bastante prometedora. En el caso de la coexistencia de ambas enfermedades, resulta fundamental el control de la hiperglucemia, la presión arterial y la proteinuria, y se priorizará la instauración de una dieta de prescripción veterinaria para el manejo de la enfermedad renal frente a una diabética.
En el presente artículo se han descrito dos de las enfermedades concomitantes que dificultan el manejo de la diabetes mellitus en la especie canina. No obstante, es necesario tener presente que cualquier patología inflamatoria o infecciosa puede afectar de manera directa en el manejo de esta endocrinopatía. En la tabla 3, se muestran diversas enfermedades comunes en la especie canina asociadas con la insulinorresistencia, que comprometen el control glucémico en los pacientes diabéticos20.
| Tabla 3. Enfermedades asociadas con insulinorresistencia en perros diabéticos (Modificada de Kooistra et al., 2025)20. |
| Obesidad |
| Infección (tracto urinario inferior, pioderma, etc.) |
| Hipotiroidismo |
| Enfermedades de la cavidad oral (enfermedad periodontal) |
| Inflamación crónica (enteropatía crónica, etc.) |
| Hiperlipidemia |
| Síndrome de Cushing |
| Enfermedad renal crónica |
| Pancreatitis |
| Diestro en hembras enteras |
| Neoplasia |
Bibliografía