Silvia López-Tamayo Picazo
Mtr. Oncología Clínica
Oncóloga Veterinaria
Imágenes cedidas por la autora
Agradecimientos: a mi colega Nuria Carreras González, por ser la mejor familia que Koda puede tener. Gracias por la confianza de dejar en mis manos la salud oncológica de tu mejor amigo.
El adenocarcinoma apocrino del saco anal (AGASAC) es una neoplasia maligna derivada del epitelio secretor apocrino de la pared del saco anal. En el perro, supone el 17 % de los tumores perianales malignos y el 2 % de todos los tumores cutáneos y subcutáneos.1,2
Características y presentación
La edad media de presentación en el momento del diagnóstico es de 9 a 11 años, pero estos tumores han sido descritos en animales de hasta 5 años.3 En los últimos estudios se ha demostrado que la aparición es similar en machos y hembras, y no queda claro que haya una incidencia mayor en pacientes esterilizados. Las razas con mayor riesgo son los spaniel, en particular el cocker spaniel, seguidas del pastor alemán, el alaskan malamute y el teckel3.
El AGASAC normalmente aparece de forma unilateral, aunque puede aparecer también bilateralmente.
Las metástasis en el momento del diagnóstico son muy comunes:
- La ratio de metástasis varía del 36 al 96 %.
- En la mayoría de los estudios se describe una tasa metastásica de al menos el 50 % en el momento del diagnóstico.
- Es más frecuente la metástasis en linfonodos (LN) regionales, principalmente LN iliaco medio, interno y sacral, tanto ipsilaterales como contralaterales.
- En cuanto a la metástasis a distancia, los sitios más comunes son pulmón, hígado, bazo y hueso y, en menor medida, corazón, vejiga de la orina, riñones, glándulas adrenales y páncreas.
- El tamaño tumoral no está relacionado con el potencial metastásico de esta neoplasia: las metástasis pueden estar presentes, aunque el tamaño del tumor sea pequeño (<1 cm). Esto quiere decir que el comportamiento biológico puede variar, ya que algunos perros con tumores primarios de gran tamaño pueden presentarse sin enfermedad metastásica, mientras que otros pueden tener un tumor primario de pequeño tamaño que haya metastatizado en el momento del diagnóstico.5
Signos clínicos
Los signos clínicos de perros con AGASAC generalmente van asociados a la presencia de la propia masa primaria, que puede causar hinchazón de la zona, lamido y sangrados.
Debido a la presencia de LN metastásicos, puede aparecer también obstrucción del canal pélvico, que cause tenesmo y estreñimiento.
La hipercalcemia paraneoplásica es un síntoma común, descrito en el 16-53 % de los perros con esta neoplasia. Se produce debido a la síntesis y secreción de un péptido relacionado con la hormona paratiroidea por parte del tejido neoplásico.6,7,8,9 Esta hipercalcemia puede provocar poliuria, polidipsia, anorexia, letargia y vómitos.
Diagnóstico
En cuanto al diagnóstico, ya que los perros con AGASAC pueden presentar síntomas clínicos sistémicos, como hemos comentado anteriormente, es importante incluir en todas las exploraciones físicas la palpación rectal de ambos sacos anales, con el fin de detectar masas. Hasta un 30 % de los casos se diagnostican tras el hallazgo incidental durante un examen físico rutinario.
El diagnóstico definitivo ha de confirmarse con una PAAF o una biopsia de la lesión. La citología mediante PAAF es muy útil para diferenciar otras lesiones de los sacos anales, como inflamaciones, infecciones o impactaciones, o detectar la presencia de otros tipos tumorales diferentes al AGASAC, como el melanoma o el CCE.
Estadiaje
Establecer el estadio clínico es de gran importancia, ya que va a influir en las decisiones terapéuticas y en el pronóstico de cada caso concreto.
Hay que tener en cuenta el tamaño del tumor y, además:
- Evaluar con pruebas de imagen el abdomen y el tórax para detectar posibles metástasis asociadas.
- Realizar radiografías torácicas (tres proyecciones) y ecografía abdominal para evaluarlos LN y otros órganos abdominales.
- Recurrir a TC/RM para planificar el posible procedimiento quirúrgico y establecer un estadio clínico preciso.
Se debe incluir también hemograma, bioquímica completa y urianálisis, ya que la presencia de hipercalcemia puede causar daño renal, lo que influirá en el manejo posterior de la enfermedad oncológica.
Manejo terapéutico
Cirugía
La cirugía se considera el pilar del tratamiento de AGASAC no metastásicos, o con metástasis de LN regionales, pero la exéresis completa del tumor primario suele ser difícil. Normalmente se consiguen resecciones marginales debido a la localización en el espacio perianal, cercana al recto y el esfínter anal, por lo que la probabilidad de recidiva es alta.10,11 Se recomienda la linfadenectomía de los LN regionales metastásicos sublumbares (iliaco medio e interno) y sacrales, para mejorar el tiempo de supervivencia, en especial si los LN obstruyen el canal pélvico o si existe hipercalcemia.3,12
Quimioterapia y radioterapia
El uso de quimioterapia y radioterapia adyuvante a los tratamientos quirúrgicos está en continuo estudio, y los protocolos todavía no están totalmente definidos.
La quimioterapia se ha recomendado tradicionalmente debido al alto potencial metastásico del AGASAC. Los citostáticos que han demostrado actividad antitumoral para este tipo de neoplasia son el carboplatino, el cisplatino, la actinomicina, la mitoxantrona y el melfalan.4,13,14
Diversos estudios afirman que no hay diferencia significativa entre el uso o no de quimioterapia adyuvante a cirugía, es decir, describen tiempos medios de supervivencia (TMS) similares.11,14 Dichos estudios son retrospectivos, y es posible que la quimioterapia fuera administrada a animales con estadios clínicos avanzados, lo que puede poner en duda la efectividad de los tratamientos adyuvantes. En contraposición, según un estudio, el empleo adyuvante de carboplatino en perros sometidos a saculectomía con o sin extirpación de LN aumentó significativamente la supervivencia.15
Los estudios más recientes muestran una mejora general en el TMS (15-28 meses) para perros con diferentes estadios de AGASAC tratados con cirugía y terapia adyuvante en comparación con los tratados solo con quimioterapia (6,9 a 8,7 meses). El TMS más alto (22-32 meses) se estableció cuando se seleccionó la radioterapia (RT) como tratamiento único o adyuvante.23
Toceranib fosfato
Se ha descrito una respuesta parcial en tumores macroscópicos con la administración de toceranib fosfato, manteniendo la respuesta hasta 25 semanas.16
Se cree que la actividad antitumoral de este ITK está relacionada con la inhibición del receptor del factor de crecimiento derivado de las plaquetas (PDGFR-β) y el receptor 2 del factor de crecimiento endotelial vascular (VEGFR-2), ambos expresados en el AGASAC, 17,18 pero esto está aún en estudio.
Un estudio reciente mostró un alto beneficio clínico del toceranib en perros con enfermedad macroscópica; además, el uso de toceranib en perros con enfermedad microscópica se asoció con una supervivencia libre de progresión significativamente más prolongada (mediana de SSP = 510 días) que en perros con enfermedad macroscópica (mediana de SSP = 255 días).27
Inhibidores de la COX-2
La COX-2 se expresa en las células epiteliales glandulares del AGASAC, lo que podría sugerir el uso de inhibidores de la COX-2 en los protocolos terapéuticos de animales con este tipo tumoral.19
Electroquimioterapia
Se ha descrito también el uso de electroquimioterapia adyuvante en cirugía con escisión incompleta del tumor primario con una dosis única de cisplatino.20
El uso de electroquimioterapia se evaluó también en un estudio retrospectivo como tratamiento único o en combinación con cirugía o quimioterapia en 10 perros con diferentes estadios de la enfermedad: seis perros (60 %) presentaron respuesta parcial, tres perros (30 %) presentaron enfermedad estable y un perro tratado por enfermedad microscópica no mostró signos de recaída local al final del estudio. Por lo tanto, los autores sugieren que la electroquimioterapia es bien tolerada y podría ser un tratamiento alternativo para el manejo de estas neoplasias.26
Pronóstico
Los principales factores pronóstico negativos son el tamaño del tumor primario, la linfadenopatía regional metastásica en la primera presentación, el tamaño y el número de los LN metastásicos, las metástasis a distancia en el momento del diagnóstico y las características histológicas del tumor primario.23
En un estudio reciente se han descrito diferencias significativas en la supervivencia y en el tiempo libre de enfermedad en función de la presencia o no de sintomatología clínica.24 La relevancia de la hipercalcemia en cuanto al pronóstico aún está en estudio, ya que existe controversia entre varios artículos: unos encuentran significativa la hipercalcemia como factor pronóstico14,8,21 y otros no encuentran diferencias en cuanto a la supervivencia entre pacientes con normocalcemia o hipercalcemia10,11,13,22. La exéresis del tumor y sus metástasis generalmente resuelve la hipercalcemia, y su recidiva suele relacionarse con la del tumor o con la presencia de metástasis a distancia.
El tamaño del tumor primario se asoció significativamente con la presencia de signos clínicos y metástasis de LN en el momento del diagnóstico.24 En otro estudio, los tumores >2,5 cm tenían de 3 a 4 veces más probabilidades de presentar metástasis que los tumores <2,5 cm.25
La linfadenopatía regional metastásica en el momento de la presentación se asocia con un peor pronóstico en la mayoría de los estudios. El tiempo libre de enfermedad (TLE) en perros con metástasis de LN en el momento del diagnóstico (110–283 días) es significativamente más corto en comparación con los perros sin metástasis (529–940 días.24 Los perros con metástasis de LN en el momento de la cirugía tienen un riesgo 2,5 veces mayor de progresión de la enfermedad que los perros sin metástasis de LN, así como un riesgo 2,31 veces mayor de muerte relacionada con el tumor.10 Aunque el pronóstico es peor para los perros con metástasis de LN, este mejora tras la extirpación de los LN metastásicos.
La curación definitiva de perros con AGASAC es improbable: el tratamiento busca obtener tiempos de supervivencia lo más largos posibles. Por el momento no existe una conformidad definitiva en cuanto al pronóstico y, como hemos comentado anteriormente, se desconoce la combinación óptima de tratamientos para el manejo de esta neoplasia. Lo que sí parece evidente es que la combinación de distintas medidas terapéuticas, que incluyen la cirugía del tumor primario y de los linfonodos metastásicos si los hubiera, junto con otras técnicas como son la quimioterapia convencional, la electroquimioterapia y la radioterapia, y la posibilidad de reintervención quirúrgica exitosa frente a las comunes recidivas, obtienen, por el momento, los máximos tiempos de supervivencia descritos para este tipo tumoral.
Son necesarios estudios prospectivos de grupos más amplios y homogéneos para esclarecer los aspectos del tratamiento multimodal y el pronóstico de este tumor que aún no están para nada claros.
Descripción del caso clínico
Acude a consulta de segunda opinión un perro macho castrado de raza mestiza de 8 años de edad, con poliuria y polidipsia de varias semanas de evolución. Se habían descartado enfermedades sistémicas y el único hallazgo evidente en las pruebas clínicas había sido hipercalemia de 13,1 mg/dl, lo que justificaba el síntoma presente.
Tras realizar de nuevo una exploración física completa, que incluyó una palpación rectal y de ambos sacos anales, se observó una masa palpable en el saco anal izquierdo, mal delimitado, duro e irregular, imposible de medir desde el exterior. Ante la sospecha de una neoplasia de saco anal, se procedió a tomar muestras para estudio citológico mediante PAF (punción con aguja fina).
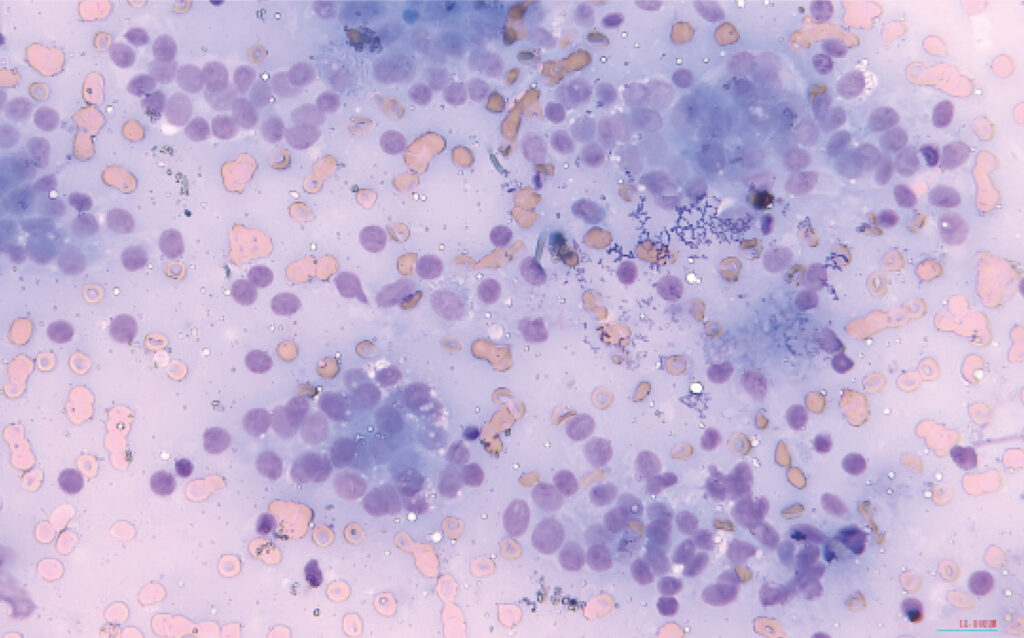
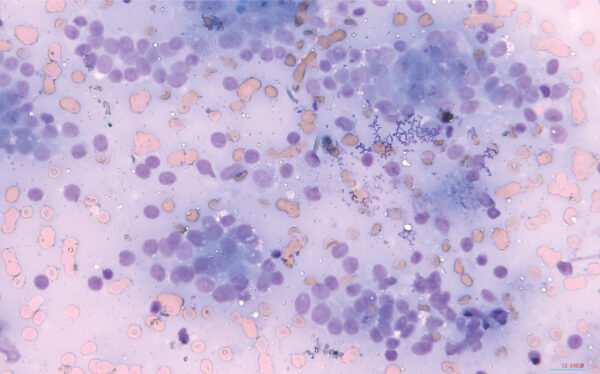
Dicho estudio reveló un elevado número de células de estirpe epitelial, distribuidas en grupos voluminosos y desorganizados, con presencia de patrón de distribución neuroendocrino, con apariencia de núcleos desnudos. Estas presentaban leve pleomorfismo nuclear, con anisocariosis, cariomegalia de moderada a grave, y recurrentes estructuras acinares. Además, se encontró un componente inflamatorio granulomatoso asociado (imagen 1). Esto fue compatible con un carcinoma de sacos anales.
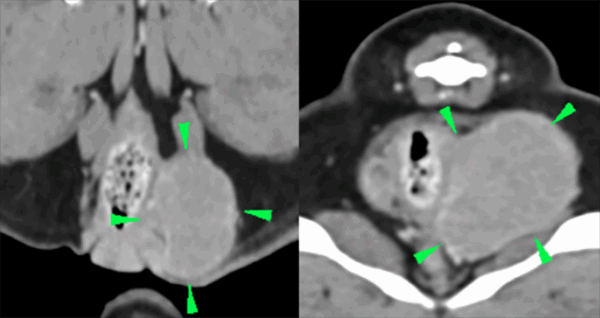
Tras el diagnóstico, y con el fin de completar el estadio clínico del paciente y trazar el plan terapéutico, se realizaron radiografías torácicas de tres posiciones (sin hallazgos fuera de la normalidad), ecografía abdominal (dentro de la normalidad) y estudio TC de tórax (sin hallazgos fuera de la normalidad) y abdomen, donde se evidenció una masa bien definida de 4,5×3,2×3,5 cm en el saco anal izquierdo, ovalada y de márgenes lisos, de atenuación tejido blando y realce homogéneo. La masa comprimía levemente el ano en su aspecto izquierdo (imagen 2). El saco anal derecho se presentaba sin alteraciones. Se observó un mínimo engrosamiento de los linfonodos glúteo y sciático izquierdos comparados con los derechos (con espesores de aproximadamente 3,5 mm). La forma y el tamaño de los linfonodos iliacos eran normales.
Se realizó la exéresis del saco anal izquierdo y se remitió la masa completa para su estudio histopatológico. La biopsia concretó la presencia de un carcinoma de glándula de saco anal var. tubular, con recuento mitótico de 23 mitosis en 10 campos hpf /2,37 mm2, sin invasión linfovascular. Tanto en los márgenes laterales como en los profundos se encontraron células tumorales en contacto, lo que confirmó la presencia de un posible remanente tumoral.
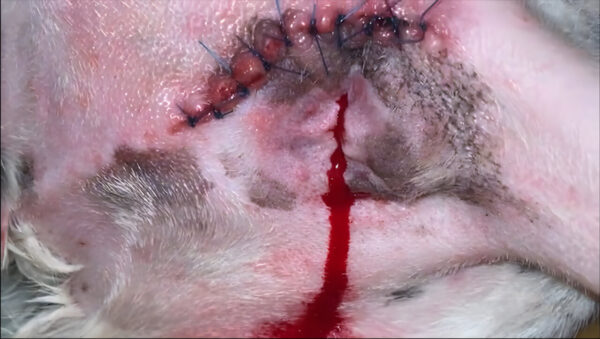
Pasadas 72 h tras la cirugía, el paciente tuvo que ser reintervenido quirúrgicamente por presentar una hemorragia activa de la arteria pudenda interna, que irrigaba el saco anal extirpado (imagen 3). Dicha complicación se solucionó con éxito.
Tras la valoración oncológica del informe anatomopatológico, dada la elevada agresividad biológica y la alta probabilidad de recidiva local de este tipo de tumor y asumiendo la presencia de enfermedad microscópica en el paciente, se decidió realizar electroquimioterapia en el lecho quirúrgico tras la administración de una dosis única endovenosa de bleomicina a razón de 15 U/m2. Este procedimiento se hizo 10 días después de la segunda intervención. Por este mismo razonamiento, y teniendo en cuenta los tiempos de supervivencia descritos en animales con AGASAC tratados con terapias combinadas, se estableció un protocolo quimioterápico a base de carboplatino 300mg/m2 IV cada 21 días, 6 dosis en total (imagen 4).

Durante todo el tratamiento quimioterápico el animal se mantuvo asintomático, con palpaciones rectales normales, y sin presencia de sintomatología asociada a la quimioterapia. Tan solo 3 días después de la primera cirugía (en la que se extirpó el tumor primario), el animal había normalizado sus niveles sanguíneos de calcio, y estos se mantuvieron en rango en todos los controles realizados posteriormente. Al terminar el protocolo con carboplatino se sometió al animal a un chequeo completo, que incluía exploración física con palpación rectal minuciosa, hemograma, bioquímica completa, radiografías torácicas (tres posiciones) y ecografía abdominal. Todas las pruebas fueron normales, sin hallazgos relacionados con la neoplasia padecida.
Basándose en el estudio que afirma un mayor tiempo de supervivencia libre de progresión de la enfermedad con el uso de toceranib fosfato en enfermedad microscópica,27 y de forma experimental, teniendo en cuenta la alta probabilidad de enfermedad residual de AGASAC, se decidió pautar, tras la quimioterapia convencional, toceranib fosfato en dosis de 2,5 mg/kg L-X-V, durante los siguientes 6 meses, con el fin de obtener el máximo tiempo posible libre de enfermedad. Durante ese tiempo el animal se mostró asintomático, con buena tolerancia al fármaco, exploraciones físicas dentro de la normalidad y controles analíticos, radiológicos y ecográficos sin hallazgos relevantes.
Al terminar los 6 meses de toceranib fosfato, el animal se sometió a un TC de tórax, abdomen y zona lumbosacra, con el fin de descartar posibles recidivas o metástasis. No se detectaron hallazgos compatibles con la enfermedad en ninguno de los cortes estudiados.
Desde el diagnóstico el animal ha presentado una supervivencia de 378 días, y hasta el momento sigue libre de enfermedad macroscópica, es decir, se mantiene sin progresión de la enfermedad, totalmente asintomático, por el momento sin tratamiento médico alguno, en vigilancia activa cada 3 meses.
Discusión y conclusiones
Los AGASAC son tumores poco frecuentes, biológicamente agresivos, originados de los sacos anales caninos. Debido a que en ocasiones pueden resultar asintomáticos en las etapas iniciales, o pueden cursar con síntomas clínicos inespecíficos, es fundamental la realización de palpaciones rectales digitales rutinarias en todos los animales de mediana edad, con el fin de detectar de manera precoz este tipo tumoral, lo que supone la posibilidad de enfrentarnos a ellos de forma multimodal.
Los factores pronósticos y los tratamientos basados en la combinación o no de distintas técnicas terapéuticas están aún en constante debate, y es necesaria la realización de estudios prospectivos con grupos de perros más numerosos y homogéneos para aclarar estos aspectos.
El objetivo terapéutico en este tipo tumoral, debido a la imposibilidad curativa, ha de ser el obtener el máximo tiempo posible de supervivencia libre de progresión de la enfermedad, lo que parece ser posible gracias a la combinación de distintas técnicas, teniendo como epicentro del tratamiento la cirugía, combinada, como en este caso, con otras terapias como la electroquimioterapia, la quimioterapia convencional y/o los inhibidores de la tirosin quinasa. No obstante, como hemos comentado con anterioridad, por el momento dichas combinaciones están todavía en estudio, y no se puede afirmar de forma definitiva cuál de ellas presenta con seguridad, los mejores resultados.
Referencias bibliográficas:
- Goldschmidt MH, Shofer FS: Skin tumors of the dog and cat, ed 1, Oxford, 1992, Pergamon Press.
- Berrocal A, Vos JH, van den Ingh TSet al., et al.: Canine perineal tumours., J Vet Med Ser A 36:739–749, 1989.
- Polton GA, Brearley MJ: Clinical stage, therapy, and prognosis in canine anal sac gland carcinoma., J Vet Intern Med 21:274–280, 2007.
- Polton GA, Mowat V, Lee HCet al., et al.: Breed, gender and neutering status of British dogs with anal sac gland carcinoma. Vet Comp Oncol 4:125–131, 2006.
- Turek MM, Forrest LJ, Adams WMet al., et al.: Postoperative radiotherapy and mitoxantrone for anal sac adenocarcinoma in the dog: 15 cases (1991-2001). Vet Comp Oncol 1:94–104, 2003.
- Meuten DJ, Cooper BJ, Capen CCet al., et al.: Hypercalcemia associated with an adenocarcinoma derived from the apocrine glands of the anal sac. Vet Pathol 18:454–471, 1981.
- Messinger JS, Windham WR, Ward CR: Ionized hypercalcemia in dogs: a retrospective study of 109 cases (1998-2003). J Vet Intern Med 23:514–519, 2009.
- Mellanby RJ, Craig R, Evans Het al., et al.: Plasma concentrations of parathyroid hormone- related protein in dogs with potential disorders of calcium metabolism. Vet Rec 159:833–838, 2006.
- Hammond TN, Turek MM, Regan J: What is your diagnosis? Metastatic anal sac adenocarcinoma with paraneoplastic hypertrophic osteopathy. J Am Vet Med Assoc 235:267–268, 2009.
- Potanas CP, Padgett S, Gamblin RM: Surgical excision of anal sac apocrine gland adenocarcinomas with and without adjunctive chemotherapy in dogs: 42 cases (2005–2011). J Am Vet Med Assoc 246:877–884, 2015.
- Wouda RM, Borrego J, Keuler NSet al., et al.: Evaluation of adjuvant carboplatin chemotherapy in the management of surgically excised anal sac apocrine gland adenocarcinoma in dogs. Vet Comp Oncol 14:67–80, 2016.
- De Swarte M, Alexander K, Rannou Bet al., et al.: Comparison of sonographic features of benign and neoplastic deep lymph nodes in dogs. Vet Radiol Ultrasound 52:451–456, 2011.
- Bennett PF, DeNicola DB, Bonney Pet al., et al.: Canine anal sac adenocarcinomas: clinical presentation and response to therapy. J Vet Intern Med 16:100–104, 2002.
- Emms SG: Anal sac tumours of the dog and their response to cytoreductive surgery and chemotherapy. Aust Vet J 83:340–343, 2005.
- Wouda RM, Borrego J, Keuler NS, Stein T (2013). Evaluation of adjuvant carboplatin chemotherapy in the management of surgically excised anal sac apocrine gland adenocarcinoma in dogs. VCO; 1-14. DOI:10.1111/vco.12068
- London C, Mathie T, Stingle Net al., et al.: Preliminary evidence for biologic activity of toceranib phosphate (Palladia®) in solid tumours. Vet Comp Oncol 10:194–205, 2012.
- Brown RJ, Newman SJ, Durtschi DCet al., et al.: Expression of PDGFR-β and kit in canine anal sac apocrine gland adenocarcinoma using tissue immunohistochemistry. Vet Comp Oncol 10:74– 79, 2012.
- Urie BK, Russell DS, Kisseberth WCet al., et al.: Evaluation of exporession and function of vascular endothelial growth factor receptor 2, platelet derived growth factor receptors-alpha and beta, KIT, and RET in canine apocrine gland anal sac adenocarcinoma and thyroid carcinoma. BMC Vet Res 8:67, 2012.
- Knudsen CS, Williams A, Brearley MJet al., et al.: COX-2 expression in canine anal sac adenocarcinomas and in non-neoplastic canine anal sacs. Vet J 197:782–787, 2013.
- Spugnini EP, Dotsinsky I, Mudrov Net al., et al.: Adjuvant electrochemotherapy for incompletely excised anal sac carcinoma in a dog. In Vivo 22:47–50, 2008.
- Turek MM, Forrest LJ, Adams WMet al., et al.: Postoperative radiotherapy and mitoxantrone for anal sac adenocarcinoma in the dog: 15 cases (1991-2001). Vet Comp Oncol 1:94–104, 2003.
- Meier V, Polton G, Cancedda Set al., et al.: Outcomes in dogs with advanced (stage 3b) anal sac gland carcinoma treated with surgery or hypofractionated radiation therapy. Vet Comp Oncol 15:1073–1086, 2017.
- Cino, M.; Martano, M. Is There Anything New in Canine AGASACA? Vet. Sci. 2024, 11, 629. https://doi.org/10.3390/ vetsci11120629
- Pradel, J.; Berlato, D.; Dobromylskyj, M.; Rasotto, R. Prognostic Significance of Histopathology in Canine Anal Sac Gland Adenocarcinomas: Preliminary Results in a Retrospective Study of 39 Cases. Vet. Comp. Oncol. 2018, 16, 518–528.
- Schlag, A.N.; Johnson, T.; Vinayak, A.; Kuvaldina, A.; Skinner, O.T.; Wustefeld-Janssens, B.G. Comparison of Methods to Determine Primary Tumour Size in Canine Apocrine Gland Anal Sac Adenocarcinoma. J. Small Anim. Pract. 2020, 61, 185–189.
- Valenti, P.; Menicagli, F.; Baldi, A.; Barella, G.; Catalucci, C.; Attorri, V.; Spugnini, E.P. Evaluation of Electrochemotherapy in the Management of Apocrine Gland Anal Sac Adenocarcinomas in Dogs: A Retrospective Study. Open Vet. J. 2021, 11, 100–106.
- Heaton, C.M.; Fernandes, A.F.A.; Jark, P.C.; Pan, X. Evaluation of Toceranib for Treatment of Apocrine Gland Anal Sac Adenocar- cinoma in Dogs. Vet. Intern. Med. 2020, 34, 873–881.