Ana Bautista Díaz1, Daniel Aguilar García2, Miguel García de la Virgen3 y Manuel Jiménez Peláez4.
1GV. Veterinaria junior del Servicio de Cirugía.
2LV, PhD, Dipl. ECVS. Especialista Europeo en Cirugía de Pequeños Animales. Clínico senior del Servicio de Cirugía.
3LV, Clínico senior del Servicio de Oncología.
4LV, MRCVS, Dipl. ECVS. Especialista Europeo y del RCVS en Cirugía de Pequeños Animales. Socio fundador, codirector y responsable del servicio Cirugía.
Aúna Especialidades Veterinarias Hospital de Referencia – IVC Evidensia (Valencia)
Imágenes cedidas por los autores
El sarcoma asociado al punto de inyección (SAPI) felino es un tipo de tumor de origen mesenquimal que se desarrolla generalmente en el tejido subcutáneo, en zonas donde se han administrado vacunas u otras inyecciones previamente. Tiene un comportamiento biológico muy agresivo localmente, de forma que la prevalencia de los tumores de alto grado es de hasta el 59 % en gatos1. Puede cursar con necrosis o ulceración, y su desarrollo parece estar vinculado a una respuesta inflamatoria crónica inducida por las inyecciones2.
La resección quirúrgica con 5 cm de márgenes laterales y dos planos biológicos de margen profundo (fascia muscular habitualmente) es el tratamiento de elección para una escisión histológica completa y un mejor control local del tumor, y permite lograr tasas de recidiva local más bajas y tiempos de supervivencia mayores1,2. En ocasiones, el defecto creado con este objetivo es demasiado grande para realizar un cierre por aposición simple directa y es necesario recurrir a técnicas más complejas de reconstrucción con colgajos3,4.
El uso de verde de indocianina para la identificación mediante linfografía de los nódulos linfáticos centinelas en cirugía oncológica es una técnica novedosa en la medicina veterinaria y ha sido reportada con hasta un 100 % de éxito como parte del procedimiento en la resección de diversos tumores cutáneos5,6,41.
El objetivo del siguiente caso clínico es la descripción de una escisión completa amplia de un SAPI felino complejo y ulcerado, utilizando la inyección peritumoral de verde de indocianina para linfografía (fluorescencia cercana al infrarojo; NIRF), linfadenectomía de los nódulos linfáticos centinelas y reconstrucción del defecto con un colgajo de avance, como tratamiento quirúrgico oncológico.
Descripción del caso clínico
Se remite una gata común europea esterilizada de aproximadamente 10 años y 5 kg, vacunada al día, por el crecimiento rápido de una masa subcutánea en la región interescapular.
Dicha masa fue detectada por primera vez como un nódulo de 1 cm, 2-3 semanas después de su revacunación frente al virus de la leucemia felina, cuya muestra citológica no resultó diagnóstica.
Tras aumentar su tamaño notablemente en los siguientes meses, llegando a ulcerarse, fue biopsiada (biopsia incisional) y se obtuvo un resultado histológico compatible con un fibrosarcoma de grado II.
Examen físico
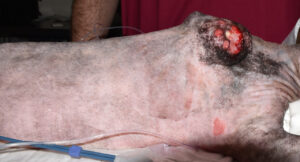
Su examen físico a su llegada a consulta fue compatible con la normalidad, a excepción de la presencia de la masa irregular, dura, adherida a planos profundos y ulcerada, de unos 5-6 cm, en la región interescapular. El linfonodo cervical superficial derecho estaba aumentado de tamaño. En punción con aguja fina de este nódulo linfático no se evidenciaron células tumorales.
Diagnóstico
Las analíticas sanguíneas y radiografías realizadas mostraron una leucocitosis neutrofílica de 23,78 K/μL leucocitos (2,87 – 17,02) y 19,63 K/μL neutrófilos (2,30 – 10,29) como única alteración reseñable.
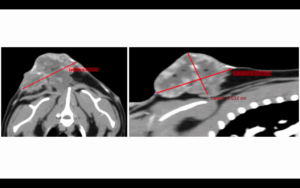
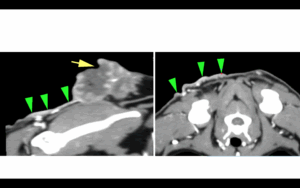
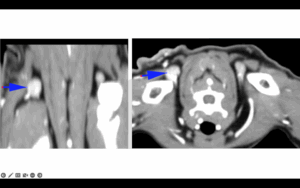
Para completar su estadificación, se realizó una tomografía computarizada (TC) torácica con administración de contraste iodado no iónico intravenoso (IV), en la que se observó una masa subcutánea vascularizada y ramificada ventro-lateralmente (derecha), de 6,3 cm de largo x 5,2 cm de alto x 3,6 cm de ancho, entre las escápulas, más compatible con un SAPI (imágenes 1 y 2). El linfonodo cervical superficial derecho estaba aumentado de tamaño (1,5 cm) (imagen 3). No se detectaron anomalías en el interior de la cavidad torácica.
Haz clic en las imágenes para ampliarlas
Cirugía
Una vez obtenidos los resultados de la TC, se procedió a su tratamiento quirúrgico oncológico con intento curativo, consistente en una resección en bloque de la masa con márgenes amplios y reconstrucción del defecto con un colgajo subdérmico de avance, con impermeabilización de la herida durante todo el procedimiento para evitar la diseminación tumoral, y en la localización y extracción de los linfonodos centinelas mediante linfografía con cámara NIRF (near-infrared fluorescence), previa inyección intradérmica peritumoral de verde de indocianina.
La paciente fue colocada en decúbito esternal con las extremidades torácicas orientadas cranealmente. La consola vídeo endoscópica conectada a una cámara NIRF, la fuente de luz y el videomonitor fueron colocados frontalmente al cirujano, craneal a la paciente, y todas las imágenes fueron visualizadas y grabadas en 4K.
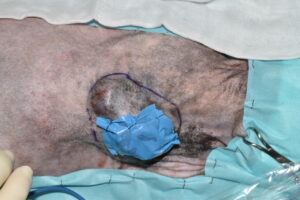
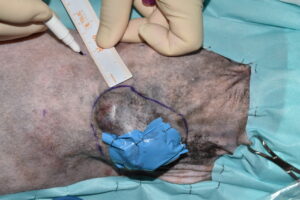
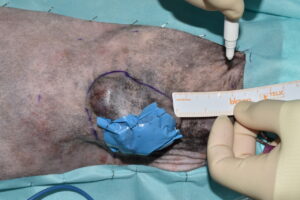
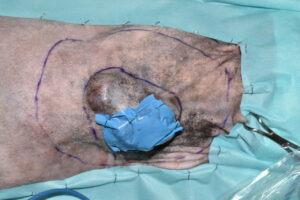
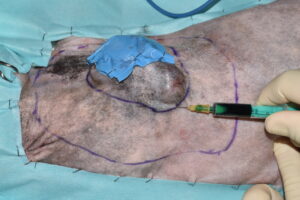
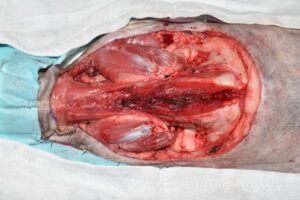
El primer paso de la intervención fue la cobertura de la úlcera con un parche de tejido impermeable, fijado circularmente con grapas a los bordes de piel íntegra, para evitar la diseminación tumoral iatrogénica durante todo el procedimiento7 (imágenes 4 y 5). Se delimitó el margen macroscópico de la masa con un rotulador quirúrgico estéril y se dibujó una segunda línea de márgenes laterales a 5 cm de distancia de la anterior (imágenes 6, 7 y 8).
Imágenes 6, 7 y 8. Imágenes del tumor impermeabilizado, con su margen macroscópico delineado, midiendo con una regla los márgenes quirúrgicos laterales de 5 cm (imágenes 6 y 7), y la línea de ese margen lateral de 5 cm una vez finalizada.
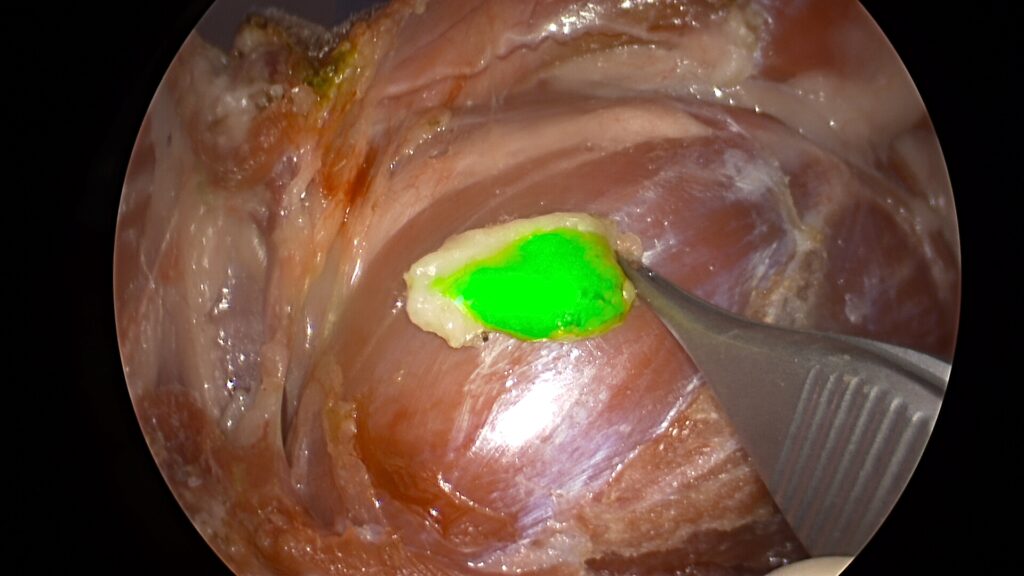
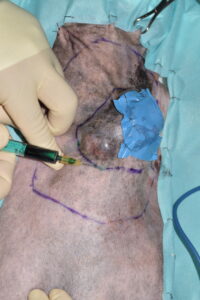
Se continuó con la inyección intradérmica de aproximadamente 1 ml de verde de indocianina en cuatro puntos cardinales alrededor de la masa (imágenes 9 y 10) y, pasados unos minutos, se visualizó la zona con la cámara NIRF, evidenciando el trayecto del verde de indocianina e identificando los linfonodos cervicales superficiales como los linfonodos centinelas.
Imágenes 9 y 10. Imágenes intraoperatorias, donde se aprecia la inyección intradérmica de aproximadamente 1 ml de verde de indocianina en cuatro puntos cardinales alrededor de la masa.
Se realizó la linfadenectomía de estos nódulos linfáticos cervicales superficiales bilateralmente de manera guiada con la fluorescencia utilizando la cámara NIRF (vídeo 1).
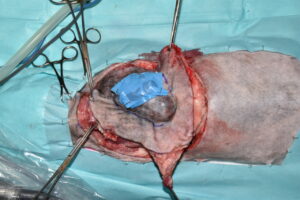
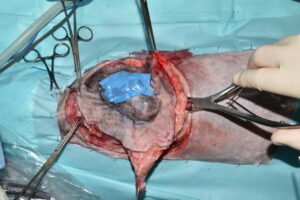
Se realizó la escisión del tumor en bloque, con la ayuda de electrocirugía mono y bipolar, incluyendo el tejido la piel, el subcutáneo, la mayor parte de los músculos latísimo del dorso y trapecios bilateralmente, además de las 10 apófisis espinosas dentro de esta área, para no romper el plano biológico profundo (imágenes 12 y 13).
Imágenes 12 y 13.
Imágenes quirúrgicas mostrando la fase de resección del tumor en bloque, incluyendo el tejido la piel, el subcutáneo, la mayor parte de los músculos latísimo del dorso y trapecios bilateralmente (imagen 12), además de las 10 apófisis espinosas dentro de esta área, usando una pinza cortante para huesos Liston (imagen 13), para no romper el plano biológico profundo.
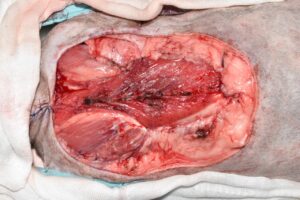
Tras asegurar la hemostasia, se realizó un lavado abundante del lecho quirúrgico con solución salina atemperada. Para cerrar el gran defecto originado tras la resección en bloque, se aproximaron y fijaron los planos musculares profundos con sutura monofilamento absorbible (imágenes 14 y 15) y se colocó un drenaje de aspiración activa Jackson-Pratt en el espacio subcutáneo.
Imágenes 14 y 15.
Imágenes quirúrgicas mostrando el gran defecto originado tras la resección en bloque (imagen 14), y una vez aproximados y fijados los planos musculares profundos del defecto, con suturas monofilamento absorbibles (imagen 15).
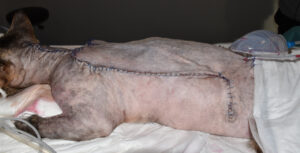
La reconstrucción del defecto se llevó a cabo mediante el cierre directo de la zona craneal cervical y la creación de un colgajo de avance craneal monopediculado subdérmico4 (imagen 16), que fue suturado en 2 planos en sus bordes, subcutáneo y piel (imágenes 17 y 18). No hubo complicaciones quirúrgicas.
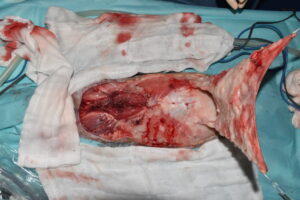
Imagen quirúrgica del colgajo de avance craneal monopediculado subdérmico, antes de suturarlo.
Imágenes 17 y 18. Imagen quirúrgica del colgajo de avance, con los bordes ya suturados en dos planos (subcutáneo y piel) con el drenaje de aspiración activa tipo Jackson-Pratt colocado en el espacio subcutáneo.
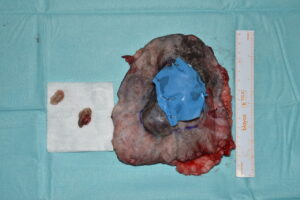
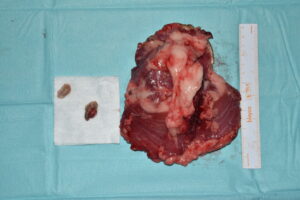
Anestésicamente se registraron valores de presión arterial por debajo del rango fisiológico, que fueron corregidos con la administración de atipamezol y la instauración de una infusión continua de noradrenalina, además de registrar una hipotermia marcada, que se resolvió en las horas siguientes con la instauración de fuentes de calor. El tejido reseccionado en bloque, con sus márgenes identificados, así como los nódulos linfáticos cervicales superficiales extirpados fueron enviados para su estudio histopatológico (imágenes 19 y 20).
Imágenes 19 y 20. Tejido reseccionado en bloque, con sus márgenes identificados, así como los nódulos linfáticos cervicales superficiales extirpados, para su envío a histopatología.
Posoperatorio
La paciente se recuperó en la unidad de cuidados intensivos durante los siguientes 3 días, donde se siguió una pauta de tratamiento analgésico con infusión continua de fentanilo a 3 μg/kg/h y de ketamina a 2 μg/kg/min, metamizol a 30 mg/kg cada 8 horas y meloxicam a 0,05 mg/kg cada 24 horas; fue dada de alta con todas sus constantes en rango. La pauta analgésica indicada en su alta incluía la administración oral de meloxicam y de buprenorfina. El drenaje de aspiración activa fue retirado a los 7 días y se realizó un vendaje compresivo de cuerpo para evitar la formación de seroma en los siguientes días.
Diagnóstico definitivo
El estudio histopatológico confirmó un sarcoma pleomórfico de alto grado con zonas de necrosis confluente y 36 mitosis en 2,37 mm cuadrados. Tanto los márgenes laterales (>3 cm) como los planos profundos (>1,5 cm incluyendo 2 planos biológicos) se confirmaron libres de enfermedad y no se evidenciaron metástasis en los nódulos linfáticos centinelas extirpados.
Evolución
A las dos semanas de la intervención, se observó una zona de necrosis delimitada en el borde craneal del colgajo, que se trató quirúrgicamente (necrosectomía y cierre) sin complicaciones adicionales. Desafortunadamente a los 6 meses de la intervención, se detectó una pequeña zona de inflamación cercana a la extremidad torácica izquierda que fue citológicamente compatible con una recidiva. Unos días después, antes de que pudiera realizarse la reintervención programada, la paciente sufrió una grave caída desde gran altura y los tutores decidieron su eutanasia.
Discusión
Un SAPI es un tumor de origen mesenquimal que se desarrolla principalmente en el tejido subcutáneo y que está relacionado con una respuesta inflamatoria local desencadenada por una inyección previa. Suelen ser muy agresivos localmente, mostrando características como un marcado pleomorfismo, alta actividad mitótica, células gigantes multinucleadas, infiltrado periférico de células inflamatorias y necrosis tumoral, algunas de las cuales han sido observadas en nuestra paciente.
Entre los distintos tipos de SAPI se encuentran los fibrosarcomas, rabdomiosarcomas, histiocitomas fibrosos malignos, sarcomas indiferenciados, osteosarcomas extraesqueléticos y condrosarcomas2,8. En un estudio, el 89 % de los SAPI extirpados fueron fibrosarcomas, de los cuales el 5 % fueron de grado I, el 35 % de grado II y el 59 % de grado III1. En otro estudio, se diagnosticó un fibrosarcoma en el 85,7 % de los casos, entre los cuales el 22,2 % eran de grado III31 y, en otro más, se reportó un 57% de los sarcomas clasificados como grado III32. El tiempo medio de aparición del tumor varía entre 4 semanas y 10 años desde la inyección9 y, pese a su comportamiento biológico, se ha descrito una baja tasa de metástasis a otros órganos2,10,11.
Las pruebas de imagen avanzada como la TC o la resonancia magnética (RM) con administración de contraste son clave para la estadificación oncológica y para una correcta planificación quirúrgica en estos casos, ya que son pruebas más sensibles para la detección de la extensión tumoral2,12,13,14. Aun así, la realización de otras pruebas prequirúrgicas como analíticas sanguíneas o radiografías de tórax están igualmente indicadas en estos pacientes y pueden ser determinantes en las decisiones quirúrgicas y en la selección del paciente. Los resultados de las pruebas realizadas a nuestra paciente, sin alteraciones analíticas significativas y sin signos evidentes de metástasis, permitieron realizar una planificación quirúrgica con intento curativo.
La resección quirúrgica en bloque del tumor con márgenes amplios se considera el tratamiento de elección para conseguir el mejor control local de la enfermedad, aunque esto no siempre es factible y se requiere la instauración de terapia adyuvante como radioterapia, quimioterapia o electroquimioterapia2,15,16,17. La resección quirúrgica con márgenes laterales ≤3 cm, o la inclusión de una sola fascia como plano profundo (plano biológico), se han relacionado con la obtención de márgenes limpios en tan solo un 50 % de los casos y con tasas de recidiva más altas, respectivamente11,18. Aunque varios estudios describen una resección con márgenes laterales de entre 3-5 cm8,16,30,33, se ha reportado una escisión incompleta en el 16 % de estos pacientes, con una tasa de recidiva del 76,2 %30. En cambio, la inclusión de al menos 5 cm de márgenes laterales y de dos fascias musculares como plano profundo, se asocia con una resección tumoral completa en hasta el 97 % de los casos y con una tasa de recidiva más baja1. Por ello, estas últimas son las referencias consideradas como más adecuadas actualmente.
Mediante la aplicación de estas pautas durante la escisión tumoral en nuestra paciente, se consiguió una extirpación quirúrgica completa, comprobada histológicamente. Sin embargo y desafortunadamente, a pesar de obtener márgenes limpios quirúrgicos, hay veces que, dada la agresividad del tumor, la recidiva local puede ocurrir, como ilustra este caso, y es algo que se le debe explicar al tutor en consulta.
Por otra parte, la realización de biopsias escisionales y la resección marginal de estos tumores están totalmente desaconsejados, ya que disminuyen los tiempos de recidiva, de supervivencia y empeoran el pronóstico, haciendo que el manejo quirúrgico con intento curativo sea más complejo o inviable2.
Se han reportado diversos casos de diseminación tumoral iatrogénica durante procedimientos quirúrgicos oncológicos, tanto en humana como en veterinaria19,20,21. Esta diseminación tumoral se ha relacionado con el uso de guantes e instrumental contaminado7, por lo que evitar la manipulación directa del tumor ulcerado mediante su impermeabilización en este caso, además de realizar un cambio de guantes y de instrumentos entre la fase de resección y de reconstrucción, son medidas necesarias en cirugía oncológica.
La identificación y el análisis de los linfonodos centinelas es importante para la cuantificación de la diseminación metastática y, por tanto, para la estadificación oncológica. Los linfonodos regionales no necesariamente coinciden con los linfonodos centinelas, que son los que drenan el tumor. Por ello, es importante el mapeo de estos linfonodos utilizando métodos como la linfoescintigrafía, más desarrollada en humana, la linfografía prequirúrgica con contraste y radiografías o TC, así como el azul de metileno o verde de indocianina que se pueden realizar de manera intraoperatoria, cada vez más utilizada en veterinaria5,6,22,23,34.
El verde de indocianina es un compuesto iodado fluorescente, considerado no tóxico, que se utiliza en medicina humana desde los años 50 y que posteriormente se ha introducido en veterinaria, donde tiene una especial aplicación en la oftalmología35,36,37. También destaca su uso en la cirugía oncológica para la detección de los nódulos linfáticos centinela38,39. Varias publicaciones, tanto humanas como veterinarias, describen un resultado satisfactorio de su uso en el 94-100 % de los casos y, en varias de ellas, se detalla la inyección peritumoral del compuesto y la detección de los linfonodos centinela en menos de 1 minuto40,41,42. Los linfonodos centinelas marcados en nuestra paciente estaban libres de enfermedad metastásica, a pesar de que uno de ellos estaba aumentado de tamaño. En cuanto a sus efectos farmacológicos, no se han reportado signos clínicos o alteraciones laboratoriales específicas asociadas a una sobredosificación del compuesto, pero se ha descrito una dosis letal media (LD50) de entre 60-80 mg/kg en ratones, 50-70 mg/kg en ratas y 50-80 mg/kg en conejos43. La posología del verde de indocianina descrita en gatos para su inyección percutánea/intradérmica es de 1 a 2 ml totales24. Hoy en día, la mayor limitación para un uso más generalizado de esta tecnología es el coste del equipamiento y también del producto.
Cuando se trata un defecto cutáneo, se debe optar primeramente por la técnica más simple, rápida y menos complicada, con el fin de evitar el mayor número de complicaciones posibles y de tener alternativas en el caso de fracaso. En cirugía reconstructiva, esto se traduce en un cierre directo simple, la creación de un colgajo y la implantación de un injerto, en ese orden4,25. Si el cierre directo del defecto no puede realizarse, como ocurrió en nuestro caso, hay que optar por la siguiente opción que sería la creación de un colgajo, ya sea de plexo subdérmico o bien de patrón axial3,4,26. La elección de dicho colgajo dependerá de la localización del defecto creado en cada caso, de la condición y temperamento del paciente, etc.3,4. Cuando los defectos creados afectan al espesor completo de las paredes torácicas (incluyendo la resección de costillas) y abdominales, que no fue nuestro caso, se pueden realizar técnicas de cierre más complejas, como la utilización de colgajos musculares, el adelantamiento del diafragma, etc.26,30. Desde la experiencia de los autores, los defectos interescapulares normalmente permiten su cierre directo simple o mediante la creación de un colgajo subdérmico de avance, como en nuestra paciente.
Entre las complicaciones posquirúrgicas asociadas a estas heridas, se encuentran las infecciones, la formación de seromas, la dehiscencia de sutura y la necrosis4. De todas ellas, destaca la necrosis craneal del colgajo por exceso de longitud con respecto a su ancho, la dehiscencia de sutura, reportada en el 11-17 % de los casos, más común en defectos interescapulares, en animales con sobrepeso, después de tiempos anestésicos y quirúrgicos más prolongados y en cierres realizados en “X”1,27. Al ser un colgajo subdérmico y, por tanto, no tener una arteria directa, hay que respetar unas proporciones entre el largo y el ancho del colgajo, para limitar el riesgo de necrosis craneal del colgajo. El largo de un colgajo subdérmico no debería exceder 1,5 veces el ancho de este. La necrosis observada en nuestro caso es ciertamente consecuencia de exceder esta ratio. Por otra parte, la formación de seromas está muy relacionada con la cicatrización y con la aparición indirecta de las dehiscencias, por lo que tomar medidas como la colocación de un drenaje de aspiración activa, la colocación de un vendaje compresivo y la restricción del ejercicio, son fundamentales en las primeras 2-3 semanas postoperatorias4.
El manejo analgésico multimodal posoperatorio con instauración de opioides, antiinflamatorios no esteroideos y anestésicos locales, se considera un punto importante en la recuperación de estos pacientes, que requieren así tiempos de hospitalización más cortos16.
Como hemos adelantado previamente, factores como la tasa o el tiempo de recidiva local, la presencia de metástasis y el tiempo medio de supervivencia, son los principales implicados en el pronóstico de estos SAPI2. A pesar de una resección quirúrgica completa de estos tumores con márgenes amplios (5 cm laterales y dos planos de fascia profundos), la tasa de recidiva local es del 14 %, mientras que la resección incompleta puede llevar a una tasa de hasta el 69 % o de más del 80 %, según diferentes artículos1,2,11,16,30. El porcentaje de casos que cursan con metástasis, principalmente pulmonar, varía entre el 0 y el 20 %, aunque algunas publicaciones describen un rango de entre un 10 y un 25-28 %1,2,16,28. Un menor tiempo hasta la recidiva, al igual que la presencia de metástasis, están relacionados con tiempos de supervivencia más cortos1,11,18,29. En un estudio, los gatos sometidos a una escisión radical sin terapia adyuvante presentaron un tiempo medio de supervivencia de 901 a 1.969 días; los que sufrieron una recidiva, vivieron una media de 499 días y los que no, 1.461 días. Aquellos que presentaron metástasis, vivieron una media de 388 días y los que no, 1.528 días1. El desarrollo de anemia, el tamaño tumoral, el tipo de tratamiento (cirugía vs. cirugía con terapia adyuvante), el grado tumoral y el índice mitótico, también han sido relacionados con el tiempo de supervivencia2. Además, la aparición de otras complicaciones posquirúrgicas no asociadas a la herida, como la ocurrencia de una parada cardiaca en pacientes sometidos a una resección agresiva de la pared costal o abdominal, también se ha relacionado con un tiempo de supervivencia más corto30. En nuestro caso, ocurre un evento imprevisto que deriva en la eutanasia de la paciente, por lo que el tiempo de supervivencia asociado a su enfermedad no pudo ser determinado, pero sí se pudo conocer el tiempo de recidiva local de la enfermedad, que podía haber sido reintervenida, dado el tamaño pequeño de la recidiva y la ausencia de metástasis a nódulos linfáticos y a distancia (pulmón).
Conclusión
El tratamiento quirúrgico agresivo con márgenes laterales amplios (5 cm) y profundos (dos planos biológicos – fascia), así como la impermeabilización del tumor durante todo el procedimiento si está ulcerado, son de gran importancia en la cirugía oncológica del SAPI. Sin embargo, a pesar del tratamiento quirúrgico agresivo y de obtener márgenes limpios amplios (>3 cm), la recidiva local puede ocurrir hasta en un 14 % de casos.
La utilización de técnicas reconstructivas, como la creación de colgajos, puede ser necesaria en estos pacientes. Para limitar ciertas complicaciones, como la necrosis de la parte más craneal del colgajo, se recomienda no exceder la longitud del colgajo más de 1,5 veces su ancho, cuando se trata de un colgajo subdérmico.
El uso de la tecnología NIRF (near-infrared fluorescence) con el verde de indocianina, es de gran utilidad en cirugía oncológica para la localización y extirpación de los linfonodos centinelas, que no en todos los casos se corresponden con los linfonodos regionales.