Esther de Lucas Tardío1 y Manuel Jiménez Peláez2
1GV. Internado Rotatorio
2LV, MRCVS, Dipl. ECVS. Especialista Europeo y del RCVS en Cirugía de Pequeños Animales. Socio fundador, codirector y responsable del servicio Cirugía
Aúna Especialidades Veterinarias Hospital de Referencia – IVC Evidensia (Valencia)
Imágenes cedidas por los autores
La reconstrucción de grandes defectos faciales/maxilofaciales puede suponer un reto, sobre todo en la especie felina. Algunas de las opciones de las que disponemos para reconstruir defectos en esta localización son los colgajos axiales, como el auricular caudal, el temporal superficial y el angularis oris, entre otros, los cuales incluyen arterias cutáneas directas, a diferencia de los colgajos subdérmicos.6,7,12,15 Este artículo describe la resección oncológica de un mastocitoma facial (palpebral) en un gato y la reconstrucción del defecto usando el colgajo axial insular auricular caudal.
Caso clínico
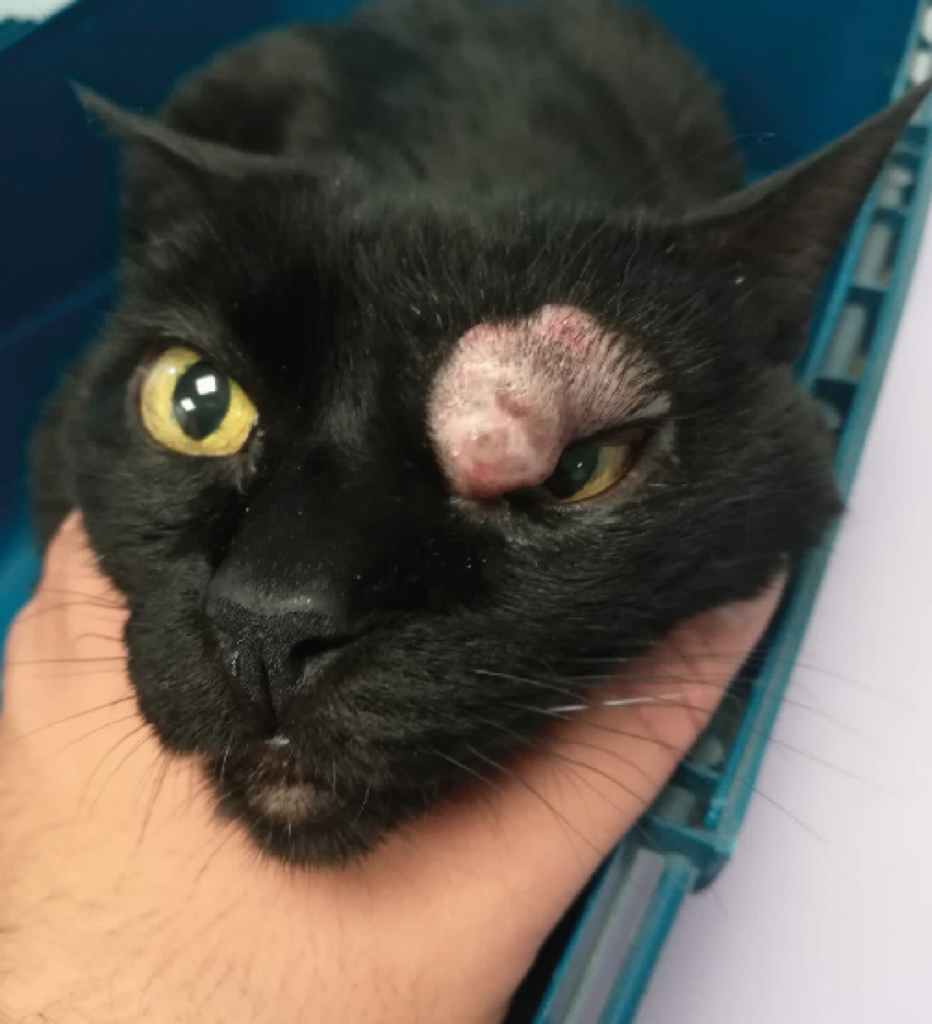
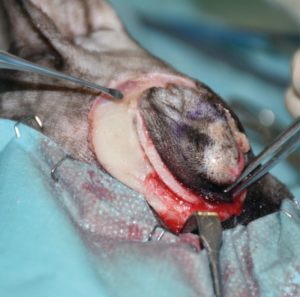
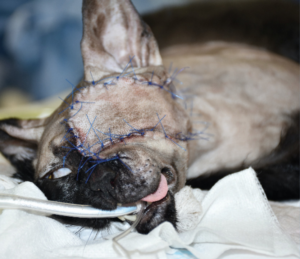
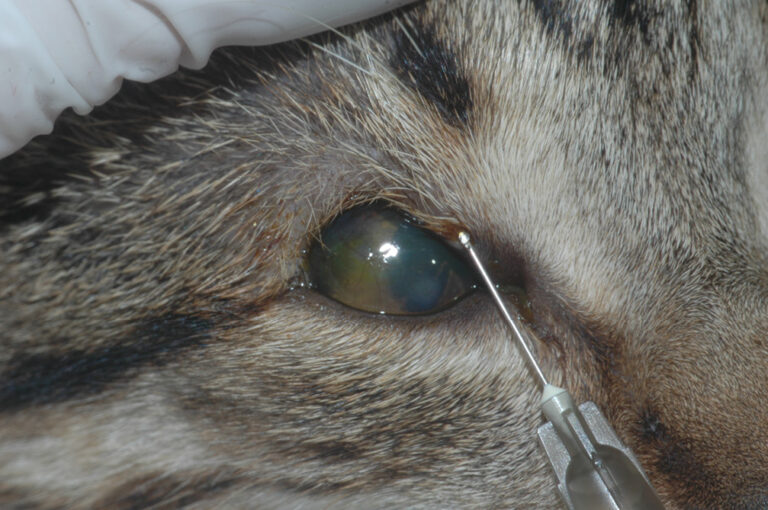
Una gata común europea, esterilizada, de 14 años, acudió a su centro habitual en Madrid debido a la aparición de una masa de 3 cm en el párpado superior del ojo izquierdo, de 2-3 semanas de evolución (imagen 1). Tras administrarle un tratamiento sintomático durante unos días, con antibióticos y antiinflamatorios, sin éxito, se realizó una analítica sanguínea sin hallazgos reseñables y una citología de la masa, que resultó compatible con un mastocitoma.
Se remitió el caso al Servicio de Oncología del hospital Aúna Especialidades Veterinarias IVC Evidensia (Valencia) que, tras su valoración y balance de extensión, lo derivó al Servicio de Cirugía para su intervención quirúrgica oncológica. La citopunción de los nódulos linfáticos mandibulares resultó negativa. Las radiografías torácicas y la ecografía abdominal no mostraron ninguna anomalía visible.
Tratamiento quirúrgico
Antes de la resección del tumor se llevó a cabo una linfadenectomía mandibular bilateral.
La cirugía prosiguió con la resección en bloque del tumor con 2 cm de márgenes laterales y un plano biológico profundo, que en este caso era hueso (hueso frontal, seno frontal, órbita y hueso nasal/maxilar).
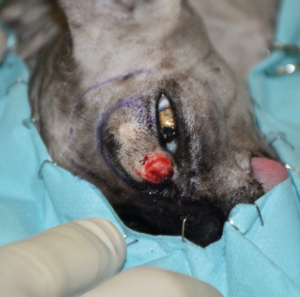
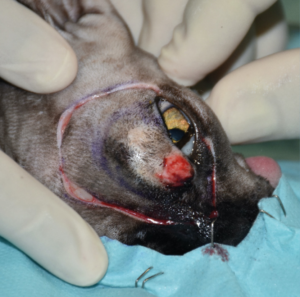
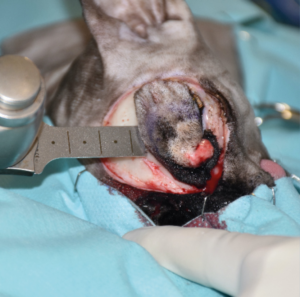
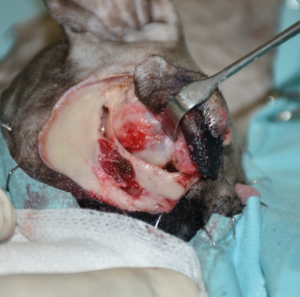
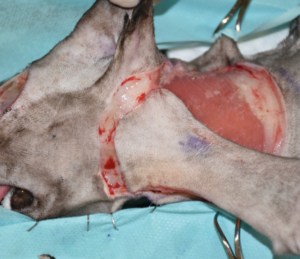
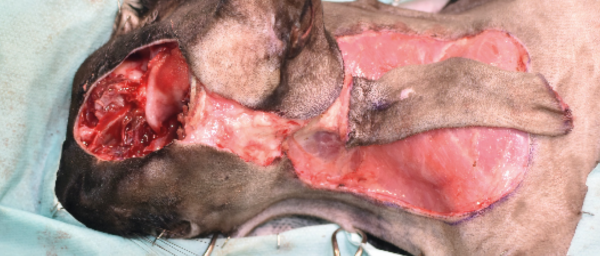
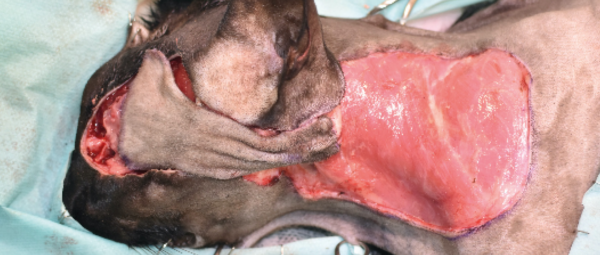
Se realizó una resección en bloque del párpado superior, incluyendo una orbitectomía parcial dorsal y exenteración ocular con ostectomía, usando una sierra oscilante de parte del hueso nasal y del hueso y seno frontal para garantizar márgenes amplios (imágenes 2A-2F).
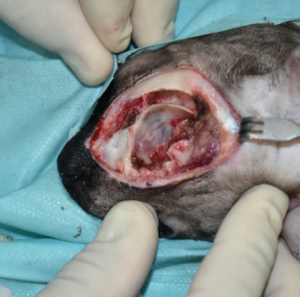
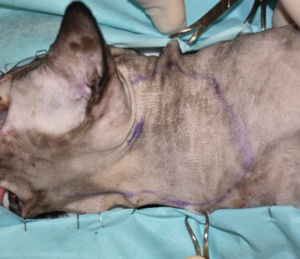
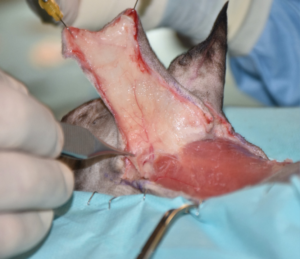
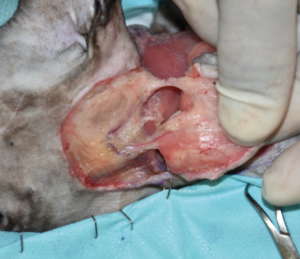
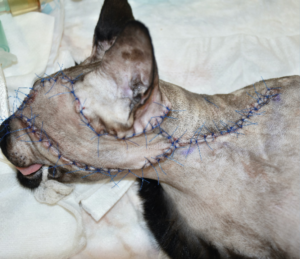
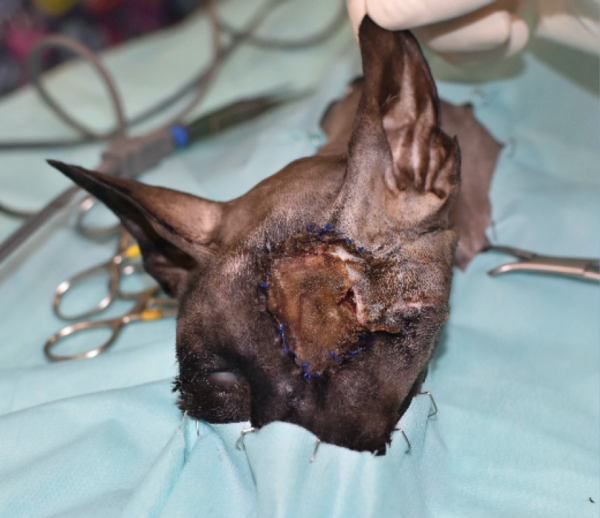
Tras realizar la hemostasia, se lavó con suero salino fisiológico y se procedió a la reconstrucción del defecto. Se optó por un colgajo axial insular auricular caudal izquierdo, con una rotación craneal de 180 grados (imágenes 3A-3F). Se cerró en dos planos, subcutáneo y piel, utilizando puntos simples de poliglecaprone 3/0 USP y polipropileno 4/0 USP, respectivamente.
La intervención quirúrgica y la anestesia se desarrollaron sin complicaciones.
Imágenes 2A-2F. Secuencia quirúrgica de la resección oncológica en bloque incluyendo todo el párpado superior afectado, orbitectomía parcial dorsal y exenteración ocular, con ostectomía usando una sierra oscilante de parte del hueso nasal, y del hueso y seno frontal para garantizar márgenes amplios.
Imágenes 3A-3F. Secuencia quirúrgica de la realización del colgajo axial insular auricular caudal para cubrir el defecto creado tras la resección oncológica.
Posoperatorio y evolución
La paciente estuvo en el área de hospitalización durante 48 horas, donde se recuperó sin complicaciones. Después, fue dada de alta con sus constantes dentro del rango fisiológico y la siguiente pauta terapéutica: cefalexina 20 mg/kg, meloxicam 0,1 mg/kg, buprenorfina 15 microg/kg y lágrima artificial en gel en el ojo derecho según evolución.
Se enviaron los tejidos extirpados para su análisis histopatológico (imagen 4). Se confirmó la sospecha de un mastocitoma, en este caso de bajo grado, con márgenes libres y sin metástasis visibles en los linfonodos.
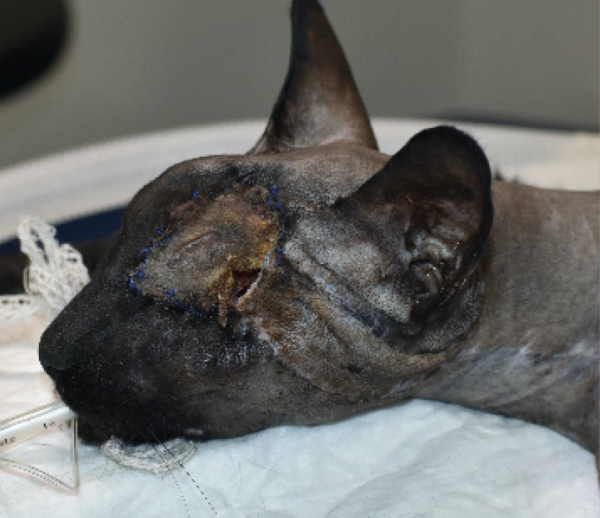
A los 15 días se retiraron las suturas cutáneas y no se apreció ninguna complicación en la herida. En esta circunstancia, mastocitoma de bajo grado con extirpación completa y sin metástasis a nódulos linfáticos, no se recomendó ningún tratamiento adyuvante.
Dos años después, la paciente no mostraba recidiva local ni metástasis pulmonares ni en linfonodos, lo que corrobora que la cirugía fue curativa.
Discusión
Los mastocitos se originan en la médula ósea y, aunque ocasionalmente pueden encontrarse en dicha área, también se pueden localizar en menor proporción en la circulación sistémica. Estas células contienen gránulos intracitoplasmáticos que son liberados en respuesta a procesos de hipersensibilidad e inflamación. Los mastocitomas son proliferaciones neoplásicas de mastocitos que pueden desarrollarse en cualquier parte del organismo, aunque generalmente se presentan de forma cutánea o subcutánea. En gatos, el mastocitoma cutáneo es la segunda neoplasia más frecuente en la piel. Debido a la liberación de sus componentes, los mastocitomas pueden producir efectos tanto locales como sistémicos, dependiendo de la localización de tumor. La diseminación metastásica sigue generalmente un patrón que afecta primero a los ganglios linfáticos, para luego extenderse al bazo, el hígado o la médula ósea.1,9
El comportamiento y la progresión del mastocitoma son muy variables. No obstante, el grado histológico constituye el principal factor pronóstico. Históricamente se ha recomendado una escisión con un margen de 3 cm en todas las direcciones y, al menos, un plano de fascia profundo (plano biológico). Sin embargo, dependiendo del grado histopatológico, puede ser suficiente con 2 cm lateralmente y un plano fascial de profundidad.5
El tratamiento definitivo y, en la mayoría de los casos, curativo de esta presentación es la realización de una cirugía. A diferencia de la especie canina, el tratamiento quirúrgico puede plantearse con márgenes más estrechos debido a la baja tasa de recidivas en esta presentación (0-24 %). En los casos donde la biopsia indique factores pronósticos negativos con márgenes incompletos, se debería recomendar una cirugía con ampliación de márgenes. 5
Características del colgajo axial auricular caudal
El colgajo axial auricular caudal incorpora las dos ramas esternocleidomastoideas de la arteria y vena auricular caudal, ubicadas en la depresión entre la cara lateral del ala del atlas y la porción vertical del canal auditivo (imagen 3D). La arteria auricular caudal emerge del músculo platisma, justo caudal al cartílago escutiforme del pabellón auricular. Estas ramas discurren en dirección caudal y dorsal, paralelas a la región cervical central, hasta anastomosarse con la arteria cervical superficial.7,10,12,17
Este tipo de colgajo se utiliza en gatos para la reconstrucción de heridas en el cuello, el dorso de la cabeza y la oreja, así como para defectos que afectan al párpado superior, al área frontotemporal y a la región orbitaria, como ocurre en casos de enucleación o exenteración ocular.4,7,10,16
El área de piel del colgajo que puede levantarse/aislarse depende del angiosoma, que es el bloque tridimensional de tejido irrigado por una arteria cutánea directa.17 Existen dos tipos de colgajos axiales:
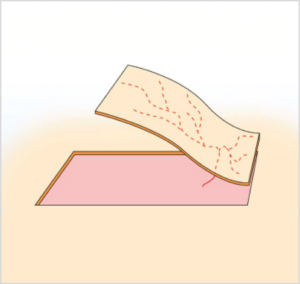
- Peninsulares: suelen tener forma rectangular. Su base cutánea se mantiene intacta y es la que aporta protección al pedículo vascular durante la disección y la rotación y también algo de vascularización (imagen 5A).7
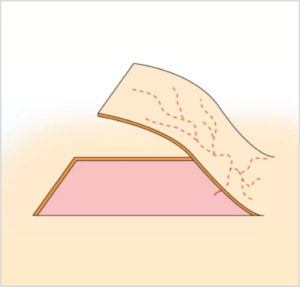
- Insulares: se incide la piel a lo largo de todos los bordes, quedando anclado únicamente el pedículo vascular (imagen 5B). Estos colgajos tienen una estética mejor y también permiten una rotación de 180° con mayor facilidad. No hay evidencia de que su supervivencia sea inferior a la de los peninsulares; sin embargo, al no contar con protección cutánea, el pedículo puede verse dañado con mayor facilidad. Se suelen usar cuando el defecto se encuentra adyacente a la base del colgajo.7,15,17
Imágenes 5A y 5B. Esquemas que ilustran la diferencia entre un colgajo axial peninsular, manteniendo el pedículo vascular y la piel (5A), y un colgajo axial insular en el que solo se preserva el pedículo vascular (5B). .
La forma de estos colgajos suele ser rectangular, pero también se pueden realizar en forma de L o en forma de “palo de hockey”: este tipo de colgajo tiene dos brazos que se unen en ángulo recto (90°) en la línea media dorsal, lo que da lugar a un colgajo más corto y ancho. Esta variación se utiliza en heridas anchas o irregulares, o bien en áreas con tensión excesiva que impiden la elevación de un colgajo peninsular, como en las zonas del flanco y la axila, donde el movimiento del colgajo puede interferir con el cierre primario. Esta configuración permite una menor rotación y presenta el mismo porcentaje de supervivencia que los colgajos peninsulares.7,17
Diferencias entre especies
En humanos, la circulación cutánea primaria proviene de las arterias musculocutáneas, que irrigan un área relativamente pequeña, lo que se asemeja en veterinaria como colgajos subdérmicos.14 En perros y gatos, el principal aporte sanguíneo a la piel proviene de arterias cutáneas directas, por lo que en estas especies es posible desarrollar colgajos de patrón axial en extensas áreas de piel.6,14 Aunque la circulación y localización de los vasos cutáneos es similar en ambas especies, existen ciertas diferencias (tabla 1):
- Los perros presentan una mayor perfusión cutánea debido a una mayor densidad de vasos subcutáneos colaterales, bien distribuidos y de orden superior, una respuesta inflamatoria temprana más intensa y una mayor velocidad de cicatrización. Este cambio se traduce en una menor formación de tejido de granulación, una cicatrización más lenta y una mayor tasa de necrosis tisular en gatos. Sin embargo, tras una semana, la perfusión en los felinos aumenta más rápidamente hasta igualarse en ambas especies.2,3,7
- Los cánidos presentan una mayor contracción de la herida, y su tegumento posee mayor resistencia.3,7 De hecho, la fuerza del defecto una semana después de la intervención es el doble que en los felinos. Sin embargo, a partir de la segunda semana, la contracción es levemente mayor en gatos, debido a que los fibroblastos tempranos no se contraen con tanta fuerza como los más tardíos.2,3 Se debe tener en cuenta que la contractibilidad no solo depende de la especie, sino también de la localización del defecto.
- Los perros tienen mayor resistencia en la piel debido a la rapidez de la producción y maduración de colágeno.2
| Tabla 1. Diferencias entre perros y gatos.2,3 | ||
| Perros | Gatos | |
| Tejido de granulación | Origen: centro de la herida.
Velocidad: mayor. |
Origen: periferia de la herida.
Velocidad: menor. |
| Perfusión cutánea | Mayor en época temprana | Menor en época temprana |
| Vasos subcutáneos | Mayor cantidad y distribución | Menor cantidad y distribución |
| Tegumento | Mayor fuerza en época temprana | Menor fuerza en época temprana |
| Seroma | Mayor cantidad durante más tiempo | Menor cantidad |
Estas diferencias implican una adaptación en el manejo de los vendajes, drenajes e incluso en el patrón de suturas, así como del tiempo de cuidados posoperatorios. Por ejemplo, mantener más tiempo las suturas cutáneas en gatos, cambiar el patrón de sutura a una que se adhiera a la dermis, el uso de estimulantes cicatriciales o la instauración temprana de colgajos podrían ayudar a la cicatrización en esta especie.2
Consideraciones prequirúrgicas
Uso de antibióticos
El uso de antibióticos prequirúrgicos depende del estado del defecto, ya que, si este presenta algún signo de infección, se debería tomar una muestra para cultivo antes de iniciar el tratamiento pre y posquirúrgico.7 En condiciones normales, se recomienda su uso profiláctico para cirugía orofacial, en cuyo caso se administran entre 30 y 60 minutos antes de la cirugía y se repite la dosis cada 2 horas durante el procedimiento quirúrgico.3,6
Preparación
Los colgajos no requieren la presencia de tejido de granulación, aunque sí deben estar libres de contaminación. En el caso de las heridas crónicas, es necesario eliminar la piel circundante, desbridar y lavar antes del cierre, lo que favorecerá una cicatrización más rápida.7
Idealmente, se posiciona al paciente de forma que el colgajo propuesto y el lecho receptor puedan prepararse simultáneamente. En este caso, el paciente se coloca en decúbito lateral, con la extremidad craneal en su posición anatómica y la espina de la escápula perpendicular al tronco.7,10,13,17
Tamaño
Para minimizar errores de cálculo, se deben realizar mediciones y marcar el trayecto de las incisiones una vez dentro de quirófano, teniendo en cuenta el posible acortamiento del colgajo.17 Para visualizar mejor cómo quedará, puede utilizarse un trozo de paño o de guante estéril, colocándolo como si fuera el colgajo definitivo.7
El flujo sanguíneo desde el angiosoma primario hacia el angiosoma secundario, a través de vasos obturadores, puede permitir que los colgajos de patrón axial alcancen hasta el doble de tamaño que los del plexo subdérmico.7,17 No obstante, cuanto mayor es su longitud, mayor es el riesgo de necrosis parcial debido a factores como la deshidratación, la hipovolemia o la hipotermia.6,10,11,16,17 Sin embargo, se recomienda extraer una cantidad suficiente de tejido para evitar tensión en la zona donante.16
Técnica quirúrgica
El angiosoma primario se localiza en el tercio medio de la cara lateral del cuello.17 La longitud máxima del colgajo puede extenderse hasta la espina de la escápula (la recomendación de los autores es no exceder la parte craneal de la escapula), mientras que su anchura máxima depende de la capacidad para cerrar la zona donante, que es mayor en gatos. Se realizan dos incisiones paralelas en el ala del atlas; en los gatos, la línea dorsal suele estar más próxima a la línea media dorsal.7,10,15,17 Este tipo de colgajos puede cubrir áreas distantes en heridas no contiguas, en cuyo caso se crea una incisión en puente para unir ambos defectos.10 Si la piel es muy abundante, puede retirarse un pequeño fragmento del puente con el fin de lograr un resultado más estético (imágenes 6A y 6B).
Imágenes 6A y 6B. Imágenes quirúrgicas de un colgajo axial insular auricular caudal siendo rotado cranealmente 180 grados, donde el donante y el receptor están a distancia, por lo que se crea una incisión en puente para unir ambos defectos, retirándose un pequeño fragmento del puente con el fin de lograr un resultado más estético.
El colgajo se eleva en dirección caudal-craneal, en peninsular, incluyendo piel y músculo platisma, desde el extremo distal hacia la base, con el fin de no interrumpir el riego arterial.10,16,17 Una vez localizada la arteria, si lo queremos convertir en insular es cuando realizamos la sección de la porción craneal de la piel del colgajo (imágenes 3B y 3C), y se rota hacia la zona receptora en dirección craneal hasta 180°, evitando la tracción excesiva. El colgajo tolera bien la rotación, pero no la combinación de rotación y tracción excesiva, ya que puede provocar una obstrucción del flujo venoso, lo que impide la circulación arterial y capilar.10,17
Una disección cutánea cuidadosa y atraumática es fundamental para preservar la integridad vascular y cutánea. Se requiere una planificación preoperatoria rigurosa y un conocimiento preciso de la anatomía regional.16 Para manipular el colgajo, se recomienda el uso de ganchos cutáneos, agujas de 25G dobladas en forma de gancho o suturas de tracción. Las incisiones cutáneas deben realizarse lo más perpendiculares posible para evitar cortes biselados, los cuales comprometerían el aporte vascular.
Los vasos cutáneos directos presentan ubicaciones predecibles en relación con referencias anatómicas, lo que permite levantar colgajos sin necesidad de visualización directa de los vasos.14,15 Sin embargo, existen pequeñas variaciones individuales, por lo que se podrían emplear mecanismos que faciliten su localización.13,16
Alguno de estos mecanismos son la inyección de azul de metileno, técnica que se ha utilizado para delimitar el tamaño del angiosoma y comparar la anatomía entre especies8. La angiografía por fluorescencia infrarroja es otra técnica que, mediante inyección intravenosa, permite visualizar intraoperatoriamente las estructuras vasculares durante un breve periodo de tiempo, facilitando así la evaluación de la perfusión tisular y los límites del colgajo. Una de las sustancias más utilizadas debido a su afinidad vascular es el verde de indocianina. También puede emplearse el Doppler.7,13
Cierre quirúrgico
En general, deben minimizarse los espacios muertos y cerrarse la piel en planos (dos) para reducir la tensión y proporcionar un lecho vascular subcutáneo a lo largo del colgajo.7 Los patrones de sutura pueden incluir combinaciones de puntos subcutáneos y cutáneos; sin embargo, el uso exclusivo de suturas cutáneas puede acelerar el cierre y evitar la rotura de vasos periféricos.16
Es recomendable colocar puntos simples discontinuos o en X en las zonas de mayor riesgo, ya que permiten un mejor drenaje, minimizan la exposición de la herida en caso de necrosis en la punta del colgajo y distribuyen la tensión de forma más uniforme a lo largo del segmento. Los puntos centrales, en general, no son necesarios y, en algunos casos, pueden estar contraindicados.7
Pronóstico
Los estudios revisados presentan una amplia variabilidad en los resultados, con tasas de complicaciones que oscilan entre el 41,8 % y el 83 %, necrosis entre el 25 % y el 67 %, y necesidad de cirugía de revisión entre el 33 % y el 50 %.6,12 No obstante, puede afirmarse que este tipo de colgajo presenta una elevada tasa de complicaciones, pero también una alta tasa de éxito global, que varía entre el 50 % y el 99 %.11,12,13 Teniendo en cuenta la alta tasa de complicaciones descritas, es recomendable avisar al tutor de una posible segunda cirugía de revisión.12,13,16,17
Cuidados posoperatorios
Tratamiento
La tensión y la inflamación generadas durante la intervención quirúrgica pueden disminuir la viabilidad del colgajo. Para reducir estos efectos, se recomienda la anestesia locorregional y la administración de antiinflamatorios no esteroideos (AINE) junto con opioides, así como la aplicación de frío local durante las primeras horas, pasando a compresas tibias en los días posteriores.6 Es fundamental evitar temperaturas extremas, ya que pueden causar hipoxia tisular.
Drenajes
Los drenajes de aspiración activa presentan la ventaja de reducir el espacio muerto en el lecho receptor y reducir las infecciones residuales, minimizando así la acumulación de líquido subcutáneo, la inflamación y el movimiento del colgajo.6,7,10,16 Sin embargo, su uso no está indicado en colgajos axiales muy pequeños o situados en regiones que no pueden drenarse adecuadamente, como en los que hay una comunicación con las vías respiratorias y no se puede hacer el vacío, como era nuestro caso.
Nutrición
Los pacientes con neoplasias faciales suelen presentar hiporexia o anorexia en el periodo prequirúrgico, y la ingestión no suele mejorar tras la cirugía. En estos casos, la colocación de una sonda de alimentación esofágica después de la intervención puede ser una estrategia eficaz para favorecer la recuperación y el estado nutricional del paciente6, aunque en nuestro caso no fue necesaria.
Complicaciones de los colgajos axiales
Dehiscencia
El aumento de la presión debajo del colgajo, junto con una disminución de la perfusión tisular, puede desencadenar la aparición de dehiscencias de suturas; esta es la complicación más frecuente de los colgajos axiales, con una incidencia aproximada de un tercio de los casos.6,17 La dehiscencia no solo compromete la integridad del cierre quirúrgico, sino que también incrementa el riesgo de infección aumentando el riesgo de necrosis. Su aparición puede evitarse mediante la reducción de tensión y la prevención del acúmulo de líquido debajo del colgajo, el uso de patrones de sutura que reduzcan tal tensión, así como con una restricción del movimiento durante el periodo posoperatorio.7,12,17
Para minimizar el riesgo de formación de seromas y, por tanto, de una de las causas de dehiscencia, se recomienda cerrar la herida por planos y considerar la colocación de drenajes de aspiración activa cuando sea apropiado.16,17
Necrosis
Las ramas cutáneas de la arteria auricular caudal se anastomosan con las ramas terminales de la arteria cervical superficial, separándose de su vaso de origen. Esta disposición anatómica hace que la porción distal del colgajo sea más vulnerable a la necrosis vascular (imagen 7).16
La necrosis del colgajo se relaciona principalmente con una mala perfusión sanguínea, que puede deberse a tensión excesiva en la línea de sutura, aumento de la presión intersticial o rotación-tracción del colgajo, lo que provoca obstrucción vascular.12,16
Los primeros signos de necrosis suelen aparecer entre las 24 y 48 horas tras la intervención e incluyen congestión, enrojecimiento o coloración violácea de la piel, junto con una disminución de la temperatura superficial.17
Imágenes 7A y 7B. Imágenes quirúrgicas de otro paciente diferente con una necrosis rostral del colgajo axial insular auricular caudal, de espesor completo, que había sido rotado cranealmente 180 grados.
Conclusiones
El mastocitoma felino es una entidad distinta a la que estamos acostumbrados a tratar en la especie canina. Esta enfermedad puede plantear escenarios muy diferentes en función de la localización (cutáneo, esplénico visceral, intestinal), y la histopatología supone una herramienta fundamental para el pronóstico de la enfermedad. La ecografía abdominal y la PAF son herramientas fáciles, rápidas y económicas con alta sensibilidad.
El pronóstico es reservado cuando los gatos presentan diseminación en el momento del diagnóstico. La cirugía sigue siendo parte fundamental del tratamiento de las diferentes presentaciones. La eficacia de la quimioterapia tradicional es limitada en la presentación macroscópica, aunque haya sido poco estudiada y se desconozca su utilidad cuando se administra de forma adyuvante a una cirugía.
Los inhibidores tirosín quinasa (ITQ) son fármacos de fácil administración y bien tolerados que pueden representar una alternativa para el tratamiento del mastocitoma felino en algunos escenarios, aunque se necesitan estudios prospectivos que determinen su utilidad en los pacientes con enfermedad macroscópica o de forma adyuvante.
El colgajo axial auricular caudal puede ser una muy buena opción para grandes defectos faciales y, al incluir vasos cutáneos directos, posee una alta tasa de éxito; sin embargo, requiere un gran conocimiento de la anatomía vascular y una correcta planificación preoperatoria. Además, deben tenerse en cuenta las diferencias fisiológicas entre especies al planificar el procedimiento y el manejo posoperatorio. Un cuidado posoperatorio adecuado es clave para mejorar la recuperación y, con ello, el éxito del colgajo.
Bibliografía:
- Blackwood L, Murphy S, Buracco P, De Vos JP, De Fornel-Thibaud P, Hirschberger J, Kessler M, Pastor J, Ponce F, Savary-Bataille K, Argyle DJ. (2012) European consensus document on mast cell tumours in dogs and cats. Vet Comp Oncol. Sep;10(3):e1-e29. doi: 10.1111/j.1476-5829.2012.00341.x. PMID: 22882486.
- Bohling, M. W., Henderson, R. A., Swaim, S. F., Kincaid, S. A., & Wright, J. C. (2004). Cutaneous wound healing in the cat: A macroscopic description and comparison with cutaneous wound healing in the dog. Veterinary Surgery, 33(6), 579–587. https://doi.org/10.1111/j.1532-950X.2004.04081.x
- Bohling, M. W., Henderson, R. A., Swaim, S. F., Kincaid, S. A., & Wright, J. C. (2006). Comparison of the role of the subcutaneous tissues in cutaneous wound healing in the dog and cat. Veterinary Surgery, 35(1), 3–14. https://doi.org/10.1111/j.1532-950X.2005.00105.x
- Del Magno, S., Giuseppe, P., Pisani, G., Morello, E., Piras, L. A., Buracco, P., & Martano, M. (2020). Caudal Auricular Axial Pattern Flap for the Reconstruction of the Upper Eyelid in Three Cats. Journal of the American Animal Hospital Association, 56(4), 236–241. https://doi.org/10.5326/JAAHA-MS-6987
- Fulcher RP, Ludwig LL, Bergman PJ, Newman SJ, Simpson AM, Patnaik AK. (2006). Evaluation of a two-centimeter lateral surgical margin for excision of grade I and grade II cutaneous mast cell tumors in dogs. J Am Vet Med Assoc. Jan 15;228(2):210-5. doi: 10.2460/javma.228.2.210. PMID: 16426187.
- Guzu, M., Rossetti, D., & Hennet, P. R. (2021, May 21). Locoregional Flap Reconstruction Following Oromaxillofacial Oncologic Surgery in Dogs and Cats: A Review and Decisional Algorithm. Frontiers in Veterinary Science. Frontiers Media S.A. https://doi.org/10.3389/fvets.2021.685036
- Johnston, S. A., Tobias, K. M. (2017). Axial Pattern and Myocutaneous Flaps. Veterinary Surgery: Small Animal Expert Consult: 2-Volume Set (2nd edn.) (pp. 1457-1472). Edra.
- Milgram, J., Weiser, M., Kelmer, E., & Benzioni, H. (2011). Axial Pattern Flap Based on a Cutaneous Branch of the Facial Artery in Cats. Veterinary Surgery, 40(3), 347–351. https://doi.org/10.1111/j.1532-950X.2011.00803.x
- Miller MA, Nelson SL, Turk JR, Pace LW, Brown TP, Shaw DP, Fischer JR, Gosser HS. (1991). Cutaneous neoplasia in 340 cats. Vet Pathology. 25(5): 389-395. Doi: 10.1177/030098589102800506.
- Pavletic, M. M. (2018). Axial Pattern Skin Flaps. Atlas of small animal wound management and reconstructive surgery. (4nd edn.) (pp. 417-461). Wiley. https://doi.org/10.1111/j.1751-0813.2010.00673.x
- Pavletic, M. M. (1981). Canine axial pattern flaps, using the omocervical, thoracodorsal, and deep circumflex iliac direct cutaneous arteries. American Journal of Veterinary Research, 42(3), 391–406.
- Proot, J. L. J., Jeffery, N., Culp, W. T. N., Buracco, P., de la Puerta, B., Williams, J. M., … Nicholson, I. (2019). Is the caudal auricular axial pattern flap robust? A multi-centre cohort study of 16 dogs and 12 cats (2005 to 2016). Journal of Small Animal Practice, 60(2), 102–106. https://doi.org/10.1111/jsap.12946
- Quinlan, A. S. F., Wainberg, S. H., Phillips, E., & Oblak, M. L. (2021). The use of near infrared fluorescence imaging with indocyanine green for vascular visualization in caudal auricular flaps in two cats. Veterinary Surgery, 50(3), 677–686. https://doi.org/10.1111/vsu.13577
- Remedios, A. M., Bauer, M. S., Bowen, C. V. A., & Fowler, J. D. (1991). Axial pattern skin flaps in cats. Microsurgery, 12(2), 125–129. https://doi.org/10.1002/micr.1920120213
- Spodnick, G. J., Hudson, L. C., Clark, G. N., & Pavletic, M. M. (1996). Use of a caudal auricular axial pattern flap in cats. Journal of the American Veterinary Medical Association, 208(10), 1679–1682.
- Stiles, J., Townsend, W., Willis, M., Moore, P. A., & Smith, E. (2003). Use of a caudal auricular axial pattern flap in three cats and one dog following orbital exenteration. Veterinary Ophthalmology, 6(2), 121–126. https://doi.org/10.1046/j.1463-5224.2003.00275.x
- Tivers, M. S. (2010). BSAVA Manual of Canine and Feline Wound Management and Reconstruction, (2nd edn.). Veterinary Record, 166(8), 100–143. https://doi.org/10.1136/vr.c983