Antonia Pons Herrera
Dolor Integrativo Veterinario
Acupuntura Veterinaria Occidental
Imágenes cedidas por la autora
El síndrome de dolor miofascial (SDM) es una condición dolorosa asociada a la presencia de puntos gatillo miofasciales (PGM) en el sistema musculoesquelético.
Se trata de un problema poco conocido en medicina veterinaria. En medicina humana, este término fue propuesto por Travell y Simons en 1983. Desde entonces, ha ganado más atención, principalmente entre los fisioterapeutas. En medicina veterinaria el primer artículo sobre dolor miofascial lo escribió en 1991 L.A Janssens, que sentó las bases para la compresión del síndrome de dolor miofascial, destacando la importancia de considerar el sistema musculo esquelético como fuente primaria de dolor en perros. En 2015, las directrices de manejo del dolor de la AAHA/AAFP para perros y gatos consideró el SDM como causa de dolor en pacientes que sufren dolor crónico.
Fisiopatología del síndrome de dolor miofascial
El SDM se describe como una afección dolorosa relacionada con la presencia de PGM en el sistema musculoesquelético. El PGM o punto gatillo miofascial se define como un foco de hiperirritabilidad muscular que genera un estímulo doloroso al sistema musculoesquelético. Los PGM pueden ser palpables y se asocian con bandas musculares tensas o “nudos”. Si se aplica presión manual en los PGM, el paciente siente dolor local y dolor referido.
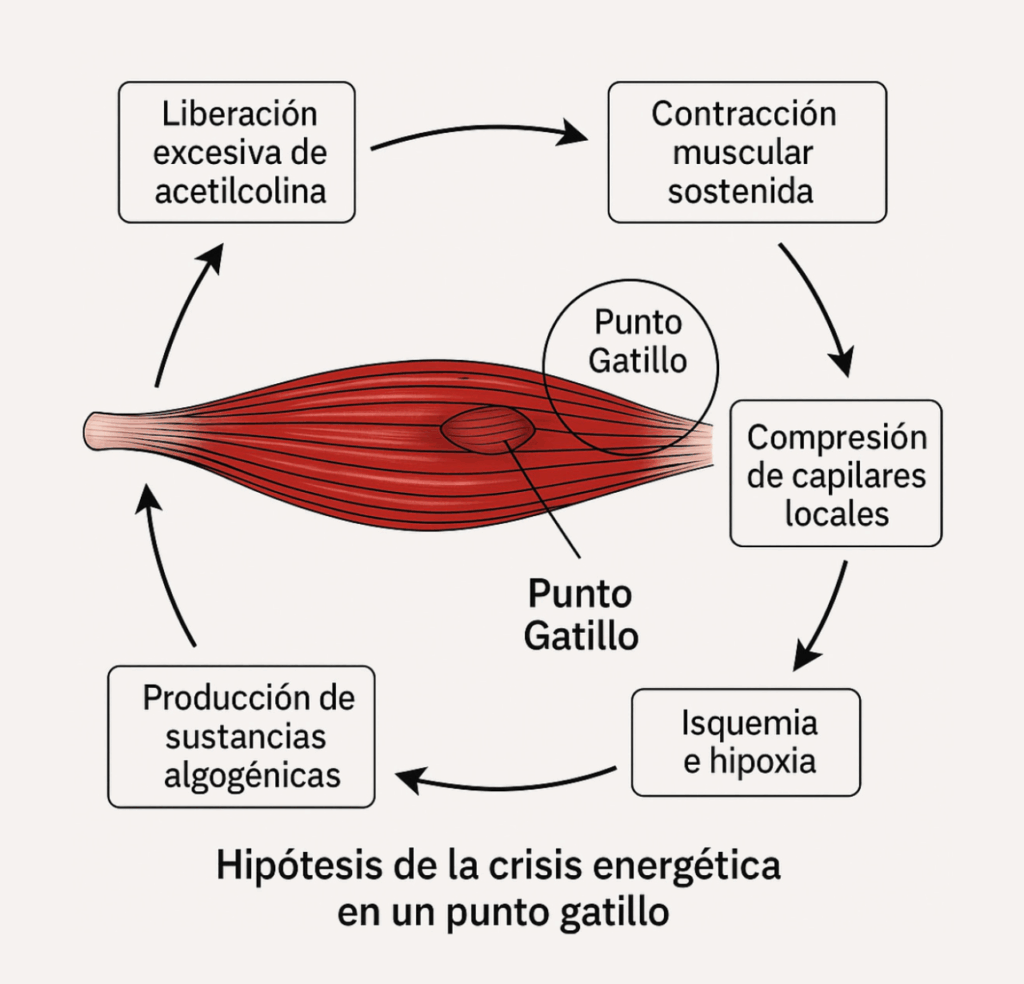
La hipótesis de la crisis energética de un PGM es una de las explicaciones más aceptadas para el desarrollo de estos nódulos dolorosos dentro del sistema musculoesquelético (imagen 1). Fue originalmente propuesta por Travell y Simons, y se ha expandido a lo largo de las décadas.
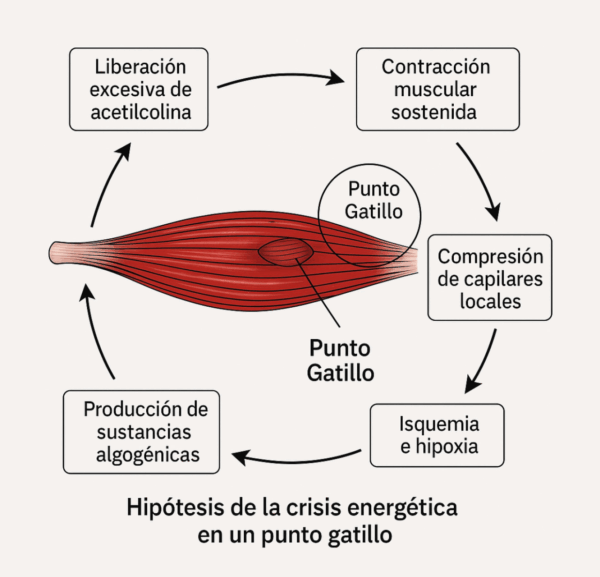
Según esta hipótesis, un PGM se forma como consecuencia de una contracción prolongada de un músculo, que origina cambios locales bioquímicos y fisiológicos iniciados por una sobrecarga aguda o repetitiva del músculo. Estas alteraciones a nivel local provocan:
- Liberación excesiva de acetilcolina (ACh) en la placa motora, que provoca una contracción muscular sostenida y localizada.
- Compresión de los capilares locales por el músculo contraído, lo cual interfiere con la perfusión sanguínea.
- Esta isquemia local conduce a una deficiencia de oxígeno (hipoxia), a una acumulación de desechos metabólicos y a un aumento de la liberación de ACh.
- Debido a la falta de oxígeno, la célula muscular no puede producir suficiente trifosfato de adenosina (ATP), que es esencial para romper el puente actina-miosina (es decir, para que el músculo se relaje).
- Esta situación genera una crisis energética, donde el músculo permanece contraído, pero sin energía para relajarse.
- Como resultado, se liberan sustancias algogénicas como bradicinina, sustancia P, serotonina, prostaglandinas y citoquinas, que activan las terminaciones nerviosas sensoriales y perpetúan el dolor.
Sensibilización periférica y central
Los PGM originan señales nociceptivas permanentes que van a desarrollar una sensibilización periférica asociada a:
- La liberación de neurotransmisores como sustancia P, bradiquinina, interleuquinas proinflamatorias (Il-6. IL-1ß, TNF-α).
- Isquemia local: lo que provoca hipoxia, se acidifica el medio y se acumulan iones H+ y ATP extracelular, que activan los receptores endovanilloides transitorios de potencial (TRPV) y los canales iónicos sensibles al acido (ASIC).
- Los PGM pueden localizarse cerca de zonas de entrada de nervios periféricos, lo que facilita la sensibilización segmentaria.
- Se origina una sensibilización periférica, que provoca una sensibilidad de los músculos con PGM activos y de los tejidos cutáneos y subcutáneos subyacentes.
La sensibilización central es un proceso neurofisiológico mediante el cual el sistema nervioso central (SNC) amplifica la respuesta al estímulo doloroso. Esto puede originar fenómenos de alodinia e hiperalgesia. Los PGM son una causa bastante común de estímulo nociceptivo crónico que puede inducir sensibilización central asociada a:
- Estimulación nociceptiva continua: los PGM activos generan señales nociceptivas persistentes hacia la médula espinal, alterando la respuesta de las neuronas del asta dorsal de la médula espinal.
- Liberación de mediadores químicos: sustancias como bradiquinina, sustancia P y serotonina aumentan la excitabilidad nerviosa en la zona del PGM.
- Plasticidad sináptica: la estimulación repetida de los PGM modifica la actividad sináptica a largo plazo, facilitando la cronicidad del dolor.
- Pérdida del control inhibitorio: se debilitan las vías inhibidoras del dolor descendentes, favoreciendo la hipersensibilidad.
- Retroalimentación patológica: la sensibilización central puede mantener y reactivar los PGM, generando un ciclo de dolor crónico.
- Los pacientes con dolor miofascial crónico muestran mayor conectividad funcional en redes de procesamiento emocional del dolor.
Causas perpetuadoras de puntos gatillo miofasciales
| Tabla 1. Resumen de las causas de formación de PGM. |
| Sobrecarga muscular y fatiga crónica |
| Lesiones musculares directas o microtraumatismo repetitivos |
| Enfermedades ortopédicas crónicas |
| Alteraciones posturales e inactividad |
| Trastornos neurológicos o debilidad muscular crónica |
| Enfermedades sistémicas |
| Procedimientos quirúrgicos |
| Estrés y factores psicológicos |
En cualquier músculo de nuestros pacientes se pueden formar PGM. Las principales causas de su aparición son:
- Sobrecarga muscular y fatiga crónica: el ejercicio extenuante en perros de trabajo o los movimientos repetitivos en animales deportistas puede llevar a la formación de PGM. Por ejemplo, debido a los saltos excesivos los perros que practican agility tienen predisposición a desarrollar PGM en músculos iliopsoas.
- Lesiones musculares directas o microtraumatismo repetitivos: traumas directos o microlesiones por movimientos repetitivos pueden desencadenar PGM.
- Enfermedades ortopédicas crónicas como la osteoartrosis (OA) pueden estar asociadas a una alta prevalencia de PGM. Los pacientes que sufren OA muestran cambios compensatorios que activan y perpetúan los PGM. Por ejemplo, un paciente con OA en la articulación coxofemoral puede desarrollar, de manera secundaria a la cojera crónica y a la compensación biomecánica, PGM en diferentes grupos musculares, como: músculos primarios afectados (glúteo superficial y glúteo medio, tensor de la fascia lata, cuádriceps), músculos secundarios que pueden ocasionar un dolor referido (illiopsoas, sartorio, músculos paravertebrales lumbares) y en las extremidades anteriores, por sobrecarga (cabeza larga del tríceps braquial, deltoides, infraespinoso).
- Alteraciones posturales e inactividad.
- Trastornos neurológicos o debilidad muscular crónica: las enfermedades neurológicas que afecten al tono muscular pueden predisponer a la formación de PGM.
- Algunas enfermedades sistémicas, como el hipotiroidismo, están asociadas a debilidad muscular y formación de PGM. Enfermedades autoinmunitarias, como la polimiositis, pueden generar dolor miofascial asociado a la formación de PGM.
- Procedimientos quirúrgicos: tiempos quirúrgicos prolongados, posiciones forzadas durante el procedimiento quirúrgico y pacientes con dolor crónico previo a la cirugía pueden desarrollar PGM. Las adherencias fasciales posquirúrgicas pueden desencadenar PGM locales y a distancia, perpetuando el dolor crónico si no se tratan adecuadamente.
- En humana se ha descrito que el estrés y/o factores psicológicos pueden influir en la aparición de PGM.
En medicina humana se han descrito otras causas perpetuadoras de los PGM que no están descritas en veterinaria, como son: deficiencia de vitamina D, deficiencia de vitamina B12, insuficiencia y deficiencia de hierro, enfermedades parasitarias, factores nutricionales y metabólicos, síndrome de hipermovilidad.
Diagnóstico de PGM
El PGM es un punto altamente irritable de dolor exquisito en un nódulo que se encuentra en una banda tensa palpable de musculo esquelético. Posee tres componentes básicos: una banda palpable en el músculo estriado afectado, un punto gatillo miofascial y un patrón característico de dolor referido.
- La banda palpable en el músculo estriado afectado se extiende a lo largo del músculo, formando una banda de consistencia aumentada. Expresa un estado anormal de tensión en la fibra muscular provocado por la contracción del nódulo palpable, da muestras de hiperalgesia, y frecuentemente de alodinia, cuando es deformado mecánicamente con estímulos como la compresión.
- Un PGM es una pequeña área focal, de 3 a 6 mm de tamaño, de irritabilidad en el músculo, que produce dolor cuando se deforma mecánicamente por compresión, estiramiento, contracción del músculo u otros estímulos. Estos PGM se pueden activar por un traumatismo directo o indirecto, esfuerzos acumulados y repetidos, alteraciones posturales, sobreestiramiento, poca actividad física.
- En medicina humana se define un patrón característico de dolor referido como un dolor difuso por isquemia: los pacientes experimentan una sensación de presión, pesadez, quemazón. El PGM puede provocar hipersensibilidad a la presión. En medicina humana existen localizaciones exactas del dolor referido según donde se localice el PGM, pero en medina veterinaria la delimitación del área afectada asociada al dolor referido es más controvertida. Comportamientos como el lamido de la zona afectada, automutilación o la retirada de la extremidad tras aplicar un estímulo táctil en la región adyacente al PGM (de manera similar a la evaluación de la alodinia) pueden sugerir la zona de dolor referido asociado.
Existen diferentes técnicas de palpación para diagnosticar un PGM:
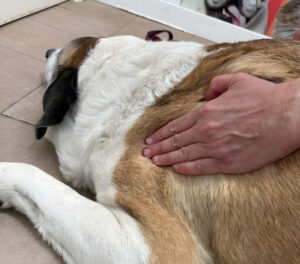
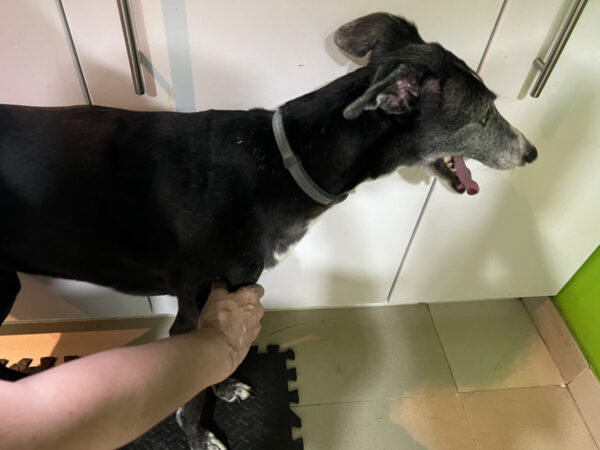
- La palpación plana en músculos accesibles, por una sola cara y relativamente superficial (imagen 2): se busca la banda tensa con la presión de los dedos a lo largo de la fibra muscular. Se emplea en músculos como el infraespinoso o el supraespinoso.
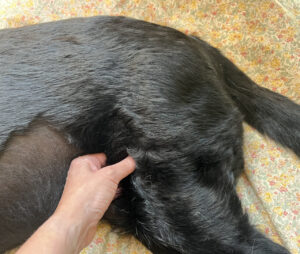
- Otra técnica es la palpación en pinza en músculos accesibles por más de una cara (imagen 3): se sujeta el vientre muscular entre el pulgar y el resto de los dedos, sosteniéndolo como una pinza y se localizan las fibras musculares mediante un movimiento transversal. Se usa en músculos como sartorio, tensor de la fascia lata. Existen estudios para el diagnóstico de PGM en medicina humana con ecografía, termografía, algometría.
Manifestaciones clínicas
Las manifestaciones clínicas de los pacientes con PGM pueden incluir alteraciones sensoriales relacionadas con el dolor, como cambios de comportamiento, retirar la extremidad o mirarla cuando se manipula la zona, vocalización, movimiento de la cola, etc.
Los PGM también conducen a alteraciones motoras, relacionadas con atrofia muscular, disminución de la flexión y extensión completa de las articulaciones, provocando una marcha rígida y forzada.
Tratamiento
El tratamiento de los PGM se puede basar en técnicas no invasivas o invasivas. Los tratamientos no invasivos consisten en terapia manual, fotobiomodulación y terapia térmica. Las técnicas invasivas consisten en punción seca, electroacupuntura, infiltración de diferentes sustancias en los PGM.
Técnicas no invasivas
Terapia manual
Compresión isquémica sostenida sobre el PGM durante 60-90 segundos hasta reducir la tensión del PGM (imagen 4). Está técnica es menos dolorosa si el músculo está en posición de acortamiento. Tras liberar el punto gatillo, se recomienda hacer ejercicios de estiramientos.
Termoterapia
Aplicación de calor superficial sobre la zona del PGM, que alivia el dolor muscular y contribuye a la relación de las fibras musculares. El calor provoca vasodilatación local y aumento del flujo sanguíneo en la zona. Esta técnica ha de combinarse con otras, como punción seca o terapia manual.
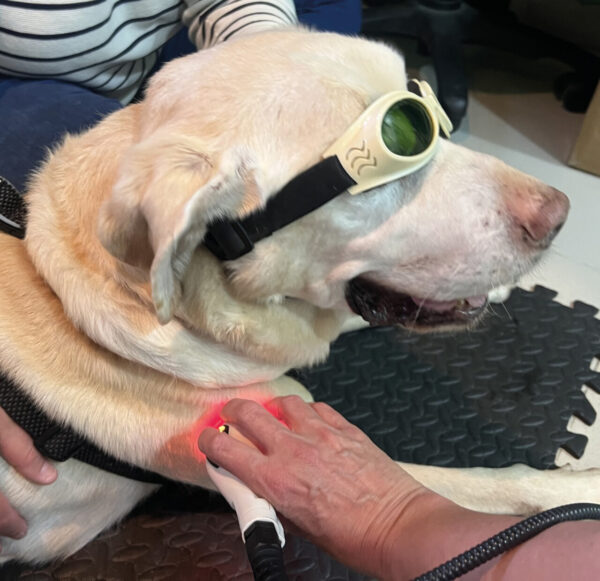
Fotobiomodulación o terapia láser
Reduce la inflamación local, mejora la microcirculación y la oxigenación tisular. La dosis recomendada por punto es de 4-10 J/cm2 (dependiendo de la profundidad del PGM) (imagen 5).
Técnicas invasivas
Punción seca
Se emplean agujas de acupuntura de diferentes tamaños y grosores según el punto gatillo que se va a tratar (imagen 6). La profundidad de la aguja oscila entre 0,5 – 5 cm según el PGM, el tamaño del paciente, e incluso su condición corporal.
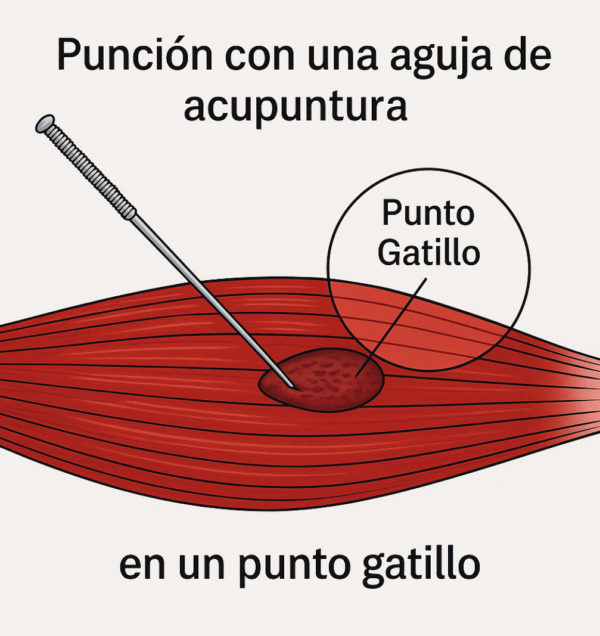
Existen diferentes técnicas de punción seca. Entre ellas, la más empleada es la técnica de inserciones múltiples de la aguja, que consiste en insertar la aguja hasta alcanzar el PGM y provocar una respuesta de espasmo local (REL). La aguja ha de insertarse de forma rápida para provocar la REL y retirarla de forma rápida también. Esta maniobra se realiza repetidamente, hasta que no veamos la REL. Es una técnica dolorosa y desagradable y no todos los pacientes están confortables durante su realización.
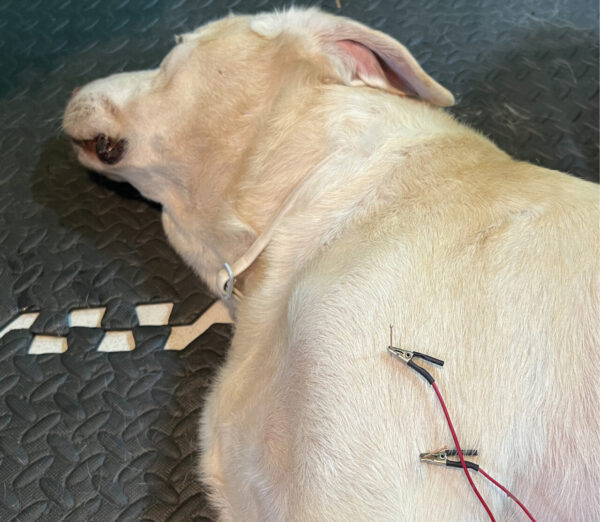
Electroacupuntura
Esta técnica combina los principios de la acupuntura y la estimulación eléctrica (imagen 7). Existen diferentes opciones: insertar agujas de acupuntura en el PGM, insertar una aguja de acupuntura en el PGM y un punto de la columna vertebral relacionado con la metámera espinal o emplear puntos de acupuntura distales con efecto analgésico. Los estudios más recientes recomiendan emplear frecuencias bajas de 2 Hz, buscando estimular la secreción de ß-endorfinas, endomorfinas 1 y 2 y encefalinas, y ajustar la intensidad hasta alcanzar una contracción muscular suave sin que el paciente muestre signos de disconfort o dolor. El tiempo de tratamiento será de 20 minutos.
Infiltración de fármacos (punción húmeda)
Se utilizan agujas hipodérmicas y lidocaína al 1 % sin epinefrina. El volumen oscila entre 0,1-0,5 ml por PGM dependiendo del tamaño del paciente y del PGM que se va a infiltrar. No se deben exceder los 6 mg/kg. El intervalo recomendado entre aplicaciones en casos crónicos es de una vez por semana, aunque se puede aumentar la frecuencia si fuera necesario. Al comparar ambas técnicas (punción seca frente a húmeda), esta última resultó mejor tolerada, provocando menos dolor.
El empleo de toxina botulínica en el manejo del dolor miofascial es otra alternativa en casos refractarios. Inhibe la liberación de acetilcolina en la placa motora, reduciendo la contracción muscular y la tensión en los PGM. Disminuye la liberación de neurotransmisores implicados en el dolor, reduce la sensibilización periférica y central. La dosis es de 1-5 U/kg (diluido en suero salino), directamente sobre el punto gatillo. Es una técnica con un coste alto para el tutor.
Conclusión
La identificación y el tratamiento de los PGM es fundamental para el control global del dolor. Los PGM pueden ser tanto agudos como crónicos, y pueden retrasar la recuperación posoperatoria y la recuperación funcional tras procedimientos quirúrgicos ortopédicos y neurológicos. En pacientes que sufren dolor crónico asociado a OA, los PGM intensifican el dolor crónico, alteran los rangos de movilidad articular, provocan compensaciones y disminuyen la calidad de vida de estos pacientes. La estimulación prolongada de los PGM puede agravar los procesos de sensibilización central, dificultando el manejo del dolor y disminuyendo la efectividad de las terapias analgésicas. El tratamiento de PGM requiere un enfoque multimodal.
Bibliografía:
- Travell, J.G. & Simons, D.G. (1983) Myofascial pain and dysfunction: the trigger point manual. Baltimore, MD: Lippincott Williams & Wilkins.
- Epstein ME, Rodanm I, Griffenhagen G, Kadrlik J, Petty MC, Robertson SA, Simpson W; AHAA; AAFP. 2015 AAHA/AAFP pain management guidelines for dogs and cats. (“2015 AAHA/AAFP Pain Management Guidelines for Dogs and Cats*”) J Feline Med Surg. 2015 Mar;17(3):251-72. Doi: 10.1177/1098612X15572062
- Fernández-de-las-Peñas C, Dommerholt J. Myofascial trigger points: peripheral or central phenomenon? Curr Rheumatol Rep. 2014 Jan;16(1):395. doi: 10.1007/s11926-013-0395-2.
- Petty MC, Monteiro BP, Robertson SA, Ajadi AR, Mosley C, Murrell JC, Nadkarni N. Myofascial pain syndrome in small animal practice. J Small Anim Pract. 2025 Feb;66(2):75-80. doi: 10.1111/jsap.13795.
- Mayoral, O & Salvat, I. Fisioterapia invasiva del síndrome de dolor miofascial. Manual de punción seca de puntos gatillo. Editorial medica panamérica.
- Broadhurst, M. A clinicians guide to myofascial pain in the canine
- Jafri MS. Mechanisms of Myofascial Pain. Int Sch Res Notices. 2014;2014:523924. doi: 10.1155/2014/523924.
- Formenton MR, Portier K, Gaspar BR, Gauthier L, Yeng LT, Fantoni DT. Location of Trigger Points in a Group of Police Working Dogs: A Preliminary Study. Animals (Basel). 2023 Sep 7;13(18):2836. doi: 10.3390/ani13182836.
- Formenton MR, Fantoni DT, Gauthier L, Cachon T, Yeng LT, Portier K. Prevalence and location of myofascial trigger points in dogs with osteoarthritis. Front Vet Sci. 2025 Jan 15;12:1488801. doi: 10.3389/fvets.2025.1488801.
- Sato, Nadia & Bastos, Bárbara & Pereira, Marco & Campos, Karina & Ambrósio, Aline & Formenton, Maira & Fantoni, Denise. (2020). “Myofascial Pain Syndrome, myofascial trigger points and trigger points in Veterinary Medicine.” (“Girthy Behaviour in Horses and Myofascial Trigger Points”) Brazilian Journal of Veterinary Research and Animal Science. 57. e164351. 10.11606/issn.1678-4456.bjvras.2020.164351.