Agustín Martínez
AniCura Aitana Hospital Veterinario (Valencia)
@agustinmartinezvet
Imágenes cedidas por el autor
La anestesia en pacientes oncológicos veterinarios representa un desafío clínico debido a los múltiples efectos fisiopatológicos que el cáncer y sus tratamientos pueden generar en el organismo. Alteraciones en la función cardiovascular, respiratoria, renal y hepática, junto con la posible inmunosupresión inducida por la enfermedad o la terapia oncológica, aumentan el riesgo de complicaciones anestésicas1. Además, el dolor asociado a los tumores y procedimientos quirúrgicos requiere un manejo analgésico eficaz para garantizar el bienestar del paciente y optimizar la recuperación posoperatoria.
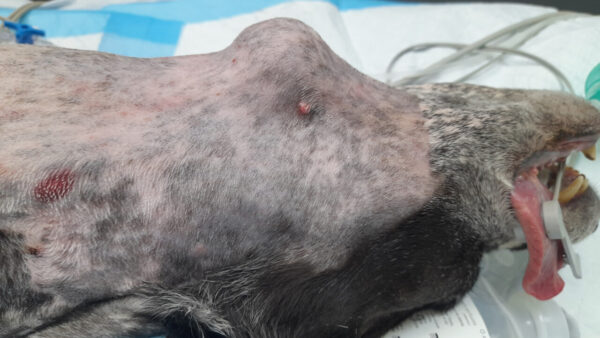
Los avances en la oncología veterinaria han mejorado la esperanza de vida de muchos animales con cáncer, lo que ha incrementado la necesidad de procedimientos anestésicos seguros para cirugías, biopsias y terapias paliativas. Sin embargo, la heterogeneidad de las neoplasias (imagen 1) y la variabilidad en la respuesta fisiológica de cada paciente hacen que la planificación anestésica deba ser altamente individualizada2.
El objetivo de este artículo es revisar las estrategias más seguras y eficaces en la anestesia de pacientes oncológicos veterinarios, abordando desde la evaluación preanestésica hasta el manejo posoperatorio. Se discutirán las mejores opciones farmacológicas, la monitorización intraoperatoria y el control del dolor, enfatizando la importancia de un enfoque multidisciplinario para mejorar la calidad de vida de estos animales.
Factores que pueden promover la metástasis
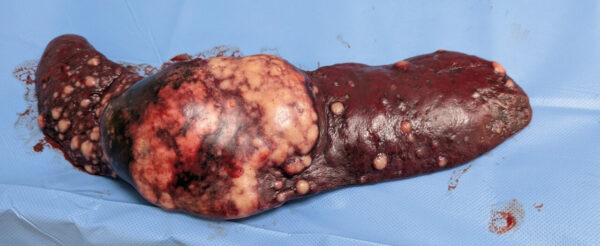
La progresión tumoral y la diseminación metastásica pueden verse influenciadas por diversos factores biológicos y fisiológicos, incluyendo la respuesta neuroendocrina y la inflamación sistémica (imagen 2). El estrés quirúrgico y la inflamación generada por procedimientos invasivos pueden alterar el microambiente tumoral, facilitando la angiogénesis, la evasión inmunitaria y la migración celular. A continuación, se presentan los mecanismos clave involucrados en estos procesos y las estrategias para su manejo perioperatorio.
Respuesta neuroendocrina y su impacto en el cáncer
La activación del eje hipotálamo-hipófisis-adrenal y la liberación de catecolaminas y cortisol en respuesta al estrés quirúrgico contribuyen a:
- Activación de receptores beta-adrenérgicos: estimula la angiogénesis y la invasividad tumoral, favoreciendo la migración celular y la formación de metástasis3.
- Producción de metaloproteinasas y factores proangiogénicos, como VEGF: facilitan la diseminación tumoral y la formación de nuevos vasos sanguíneos que nutren al tumor, aumentando su agresividad4.
- Entre las estrategias para reducir el estrés prequirúrgico se pueden incluir:
- Administración de ansiolíticos como gabapentina (20-25 mg/kg) y melatonina (1-3 mg/kg) la noche previa y antes de la consulta.
- Implementación de cuidados no farmacológicos: ambiente tranquilo y manejo delicado para reducir la activación del eje neuroendocrino.
Inflamación y microambiente tumoral
La inflamación asociada al cáncer puede dividirse en:
- Inflamación primaria: inherente al tumor y su microambiente. La activación de citoquinas inflamatorias como IL-6 y TNF-α contribuye a la proliferación tumoral y a la resistencia a la apoptosis5.
- Inflamación secundaria: inducida por procedimientos diagnósticos y terapéuticos. La cirugía y la quimioterapia pueden desencadenar una respuesta inflamatoria sistémica que favorece la progresión tumoral y la diseminación metastásica6.
Las cirugías y quimioterapias generan un estado inflamatorio sistémico que puede favorecer la proliferación tumoral. La elección adecuada del protocolo anestésico es esencial para minimizar estos efectos. Se ha demostrado que el uso de técnicas de anestesia locorregional puede reducir la respuesta inflamatoria y mejorar el pronóstico oncológico7.
Evaluación preanestésica
La evaluación preanestésica en pacientes oncológicos es un paso fundamental para identificar riesgos y optimizar el manejo anestésico. Debido a las alteraciones sistémicas que puede generar el cáncer y sus tratamientos, es esencial realizar una valoración completa que permita seleccionar los fármacos y técnicas más seguras para cada paciente1.
Una anamnesis detallada es clave para conocer el estado general del paciente, su historial médico, tratamientos en curso y síntomas asociados a la neoplasia. Es importante indagar sobre signos como pérdida de peso, letargia, disnea, vómitos o sangrado anormal, que pueden indicar complicaciones sistémicas. Además, se debe registrar cualquier antecedente de sensibilidad a fármacos o respuestas adversas previas a la anestesia8.
El examen físico debe incluir una evaluación minuciosa de los sistemas cardiovascular y respiratorio, así como de la hidratación y el estado nutricional. En casos de tumores de gran tamaño o masas torácicas, la inspección y auscultación pulmonar permiten detectar posibles alteraciones que podrían comprometer la ventilación bajo anestesia.
Para una planificación anestésica segura, es fundamental realizar algunas pruebas diagnósticas que permitan evaluar la función de órganos clave.
Con base en la evaluación clínica y los resultados de las pruebas complementarias, se debe establecer la clasificación del riesgo anestésico según la escala de la American Society of Anesthesiologists (ASA), adaptada a veterinaria.
Los pacientes oncológicos suelen clasificarse en ASA II a IV, dependiendo de la afectación sistémica del cáncer y la presencia de complicaciones como insuficiencia orgánica o coagulopatías8.
Selección de fármacos anestésicos
La elección de los agentes anestésicos en pacientes oncológicos debe basarse en su estado clínico, las comorbilidades asociadas y los efectos secundarios de los fármacos. Dado que estos pacientes pueden presentar disfunciones orgánicas y alteraciones en la respuesta a la anestesia, es fundamental seleccionar fármacos con un perfil hemodinámico estable y minimizar los efectos adversos que puedan comprometer la recuperación.
Sedación: opciones seguras y contraindicaciones
Los sedantes se utilizan para reducir la ansiedad y facilitar la manipulación del paciente antes de la inducción anestésica. En oncología veterinaria, se debe tener especial precaución con agentes que afecten a la función cardiovascular o respiratoria.
- Acepromazina: presenta efectos inmunomoduladores a través de la disminución de especies reactivas de oxígeno (ROS) en neutrófilos activados. No existe investigación en animales o humanos, y no hay evidencia relacionada con la progresión del cáncer ni metástasis.
- Benzodiacepinas (midazolam, diazepam): proporcionan sedación leve y efecto ansiolítico sin impacto significativo en la hemodinámica. son seguras en pacientes debilitados, aunque pueden causar excitación en animales jóvenes y sanos. El uso de diazepam debería ser evitado, ya que reduce la fagocitosis de neutrófilos y macrófagos, además de disminuir la actividad neutrofílica. Es preferible la utilización de midazolam, ya que disminuye los niveles de IL-8, un factor clave en adhesión, migración y angiogénesis.
- Agonistas α2-adrenérgicos (dexmedetomidina, medetomidina): poseen efectos sedantes y analgésicos potentes, pero pueden inducir bradicardia y depresión respiratoria. Deben usarse con precaución en pacientes con enfermedad cardiovascular o hipovolemia8.
- En cuanto a la anestesia oncológica, es recomendable ya que posee una marcada acción antiinflamatoria al reducir los niveles de TNF-α e IL-6. Además, modula la respuesta inmunitaria mediante la vía TLR4 – NFĸB, lo que limita la producción de citoquinas proinflamatorias. A su vez, favorece la fagocitosis de los macrófagos, contribuyendo a una respuesta inmunitaria más eficiente.
Inducción anestésica: ventajas y desventajas de diferentes agentes
La inducción anestésica en pacientes oncológicos debe realizarse con fármacos de acción rápida y mínima repercusión hemodinámica. Entre las opciones más utilizadas se encuentran:
Propofol
De rápida acción y metabolización hepática, es una opción segura en la mayoría de los casos.
Además de su función anestésica, el propofol ha mostrado potencial como protector antitumoral, ya que afecta a la capacidad de invasión tumoral mediante varios mecanismos:
- Preserva la inmunidad celular, favoreciendo la respuesta del organismo contra células malignas.
- Estimula la actividad de las células NK (Natural Killer), que juegan un papel clave en la eliminación de células cancerosas.
- Inhibe la ciclooxigenasa-2 (COX-2), una enzima asociada con la inflamación y el crecimiento tumoral.
- Inhibe la prostaglandina E2 (PGE-2), una molécula involucrada en la inmunosupresión y la progresión del cáncer.
Alfaxalona
Presenta un perfil similar al propofol, pero con menor depresión cardiovascular. Aunque su efecto sobre la progresión tumoral y la inmunomodulación aún no está completamente esclarecido, se considera una opción segura para la inducción y el mantenimiento anestésico en estos pacientes. Su principal ventaja es la mínima alteración de la función de las células NK y la respuesta inflamatoria, factores clave en la vigilancia contra la diseminación tumoral.
Etomidato
Es un agente anestésico intravenoso utilizado por su estabilidad hemodinámica, lo que lo hace atractivo en pacientes oncológicos con riesgo cardiovascular. Sin embargo, en el contexto de la anestesia oncológica, su principal limitación es la supresión transitoria del eje adrenal, lo que puede comprometer la respuesta al estrés quirúrgico y afectar a la inmunidad.
Aunque no se ha relacionado directamente con un aumento en la progresión tumoral, su impacto en la producción de cortisol podría influir en la respuesta inflamatoria y la función inmunitaria. Por ello, su uso en pacientes con cáncer debe evaluarse cuidadosamente, especialmente en cirugías de larga duración o en pacientes con insuficiencia adrenal preexistente.
Ketamina
Ha sido objeto de controversia en anestesia oncológica debido a su impacto inmunológico. Tradicionalmente, se la consideraba un fármaco metastásico, ya que suprime la actividad y población de células NK por hasta tres semanas, reduce la producción de linfocitos y modula la inflamación a través de la vía TLR4-NFĸB, disminuyendo la producción de citoquinas. Además, su efecto simpaticomimético podía favorecer un entorno tumoral propicio.
Sin embargo, estudios recientes han revelado que la ketamina también posee efectos antiinflamatorios, antineoplásicos y neuroprotectores, además de reducir la expresión de citoquinas proinflamatorias como TNF-α e IL-2, lo que ha abierto nuevas líneas de investigación sobre su posible beneficio en el contexto oncológico.
Mantenimiento anestésico: isoflurano vs. sevoflurano vs. TIVA
La anestesia inhalatoria con halogenados ha sido asociada con efectos inmunosupresores en el contexto oncológico. Se ha demostrado que disminuye la actividad de los linfocitos T y las células NK en el pulmón durante hasta 12 días, lo que podría comprometer la vigilancia inmunológica contra la diseminación tumoral. Además, promueve una mayor expresión de los factores inductores de hipoxia HIF-1 y HIF-2, los cuales favorecen un microambiente tumoral propicio para la progresión del cáncer y protegen las células tumorales residuales, aumentando el riesgo de recurrencia9.
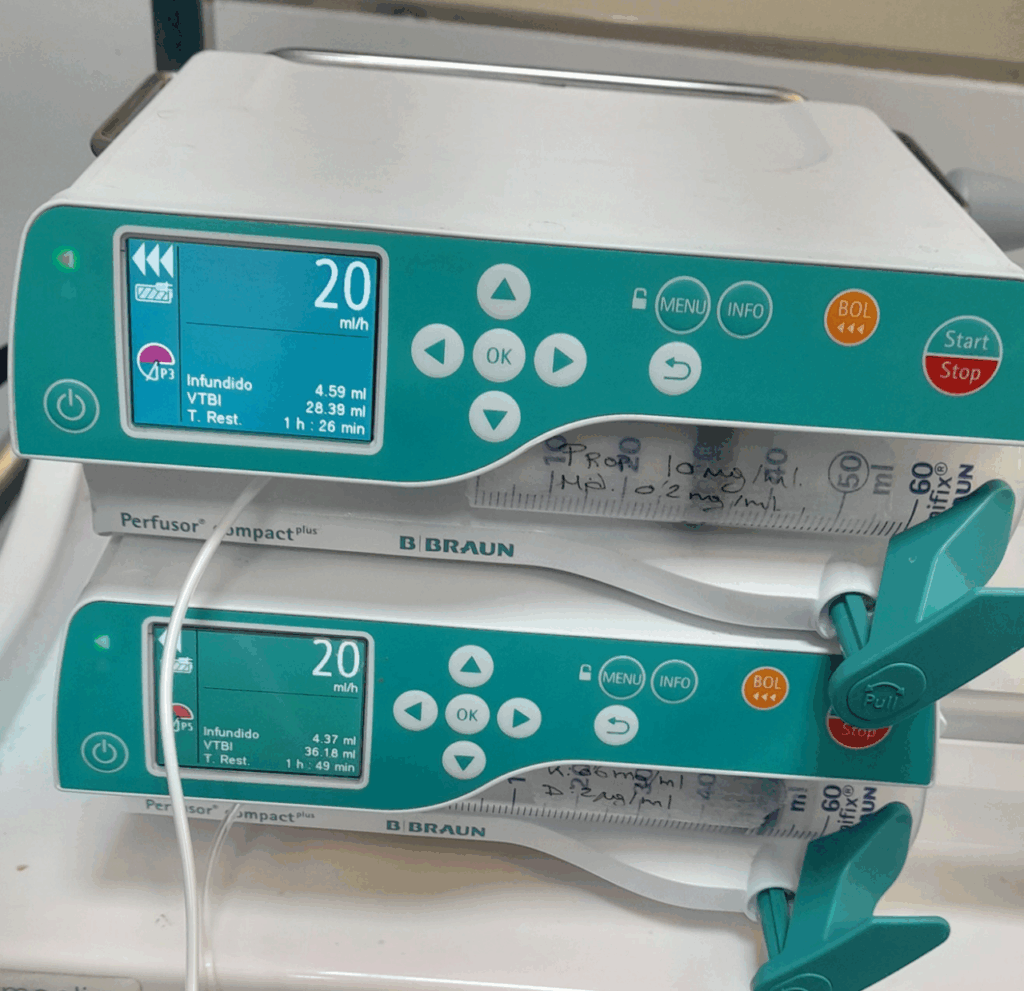
En contraste, la anestesia intravenosa total (TIVA), especialmente con propofol, ha demostrado ser una opción más favorable en pacientes oncológicos. Se asocia con un menor impacto en la inmunidad, una menor expresión de factores protumorales y una mejor preservación de la función de las células NK, lo que podría contribuir a una menor tasa de recurrencia tumoral. Por estas razones, la TIVA se considera la mejor opción en la anestesia oncológica siempre que sea posible (imagen 3).
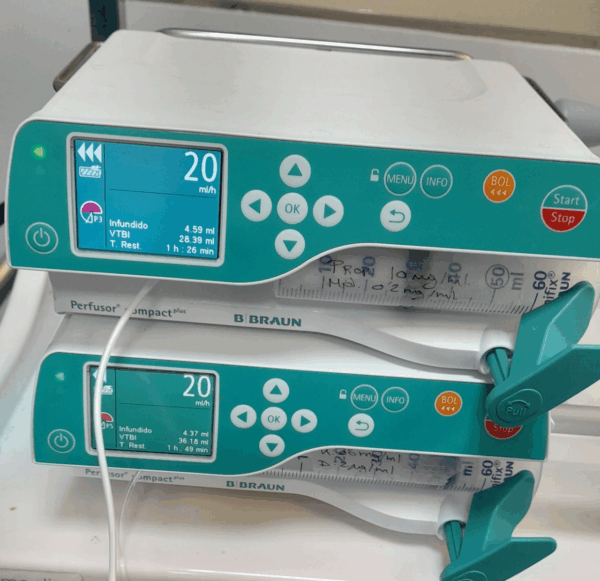
Manejo del dolor y analgesia multimodal
El control del dolor en pacientes oncológicos es un aspecto fundamental de la anestesia veterinaria. Estos animales pueden experimentar dolor agudo debido a procedimientos quirúrgicos o dolor crónico relacionado con la progresión tumoral. Un manejo inadecuado del dolor no solo afecta el bienestar del paciente, sino que también puede provocar respuestas fisiológicas adversas como inmunosupresión, estrés metabólico y retardo en la recuperación postoperatoria10.
El enfoque multimodal es la estrategia más efectiva para la analgesia en oncología veterinaria. Consiste en combinar diferentes clases de fármacos analgésicos que actúan en múltiples sitios del sistema nervioso, permitiendo un mejor control del dolor con menores dosis de cada agente y reduciendo los efectos adversos11.
Analgesia sistémica
Los opioides son la base del manejo del dolor en pacientes oncológicos, ya que proporcionan analgesia potente sin afectar negativamente la función cardiovascular. Su combinación con antiinflamatorios no esteroideos (AINE) y otros fármacos adyuvantes mejora la eficacia analgésica.
Sin embargo, los opioides en anestesia oncológica afectan a la respuesta inmunitaria al alterar diversas funciones celulares. Reducen la capacidad fagocítica de los macrófagos y disminuyen la actividad de las células NK, interfiriendo con la presentación antigénica. Además, inhiben la proliferación de linfocitos T, reducen la respuesta celular a Th1 y aumentan su apoptosis. En el caso de los linfocitos B, dificultan su transformación en células plasmáticas, afectando la producción de anticuerpos.12
En el contexto de la anestesia oncológica, el impacto inmunosupresor de los opioides ha impulsado el uso de estrategias como la anestesia libre de opioides (OFA, Opioid-Free Anesthesia) y la anestesia ahorradora de opioides (OSA, Opioid-Sparing Anesthesia). Estas técnicas buscan minimizar el uso de opioides mediante alternativas como bloqueos locorregionales, agonistas α2, ketamina, lidocaína sistémica y AINE, con el objetivo de preservar la función inmunitaria y reducir el riesgo de recurrencia tumoral13 (imágenes 4 y 5).
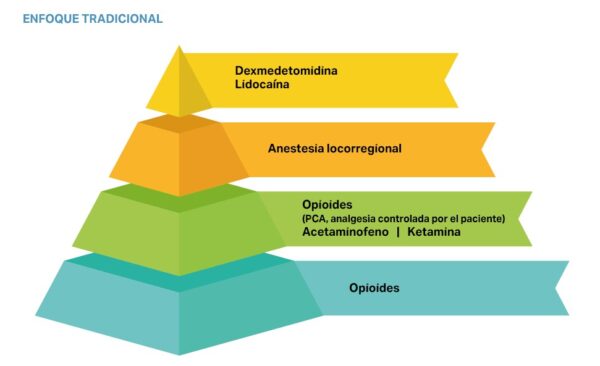
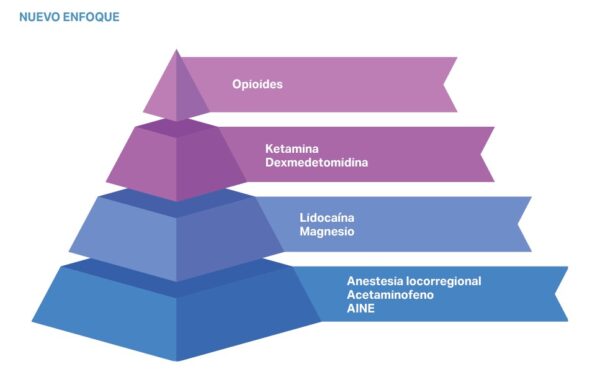
Por otro lado, la ciclooxigenasa-2 (COX-2) desempeña un papel clave en la progresión tumoral al favorecer la angiogénesis, el crecimiento del tumor, la metástasis, la quimiorresistencia, la resistencia a la apoptosis y la inmunodepresión. Los antiinflamatorios no esteroideos (AINE), al inhibir la COX-2, pueden reducir estos procesos, ofreciendo un potencial beneficio en el control del cáncer al limitar su proliferación y diseminación.
Anestesia locorregional
La anestesia locorregional es la mejor opción para el control del dolor en anestesia oncológica, ya que proporciona un alivio efectivo y duradero sin efectos sistémicos. Al bloquear la transmisión del dolor de manera específica, permite una recuperación más rápida y reduce la necesidad de fármacos. Sin embargo, su aplicación requiere una curva de aprendizaje, ya que su correcta ejecución es clave para garantizar un control óptimo del dolor y maximizar sus beneficios en pacientes oncológicos (imagen 6).
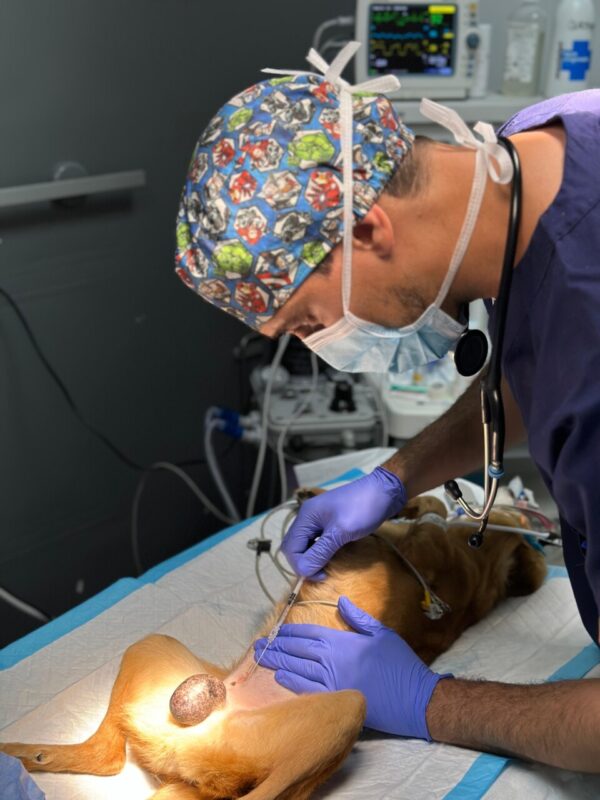
Monitorización y manejo intraoperatorio
La monitorización anestésica en pacientes oncológicos es esencial para detectar y prevenir complicaciones intraoperatorias, dado que el cáncer y sus tratamientos pueden generar inestabilidad hemodinámica, hipoxia y alteraciones en la respuesta a los anestésicos.
Se recomienda una monitorización continua de las funciones cardiovascular, respiratoria y metabólica para optimizar la seguridad del procedimiento14 (imagen 7).
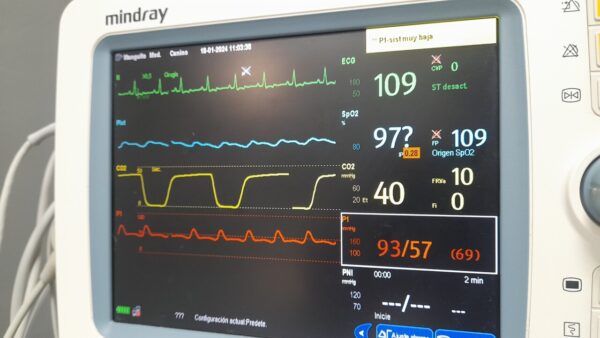
Cuidados posoperatorios y recuperación
El periodo posoperatorio es una fase crítica en la anestesia de pacientes oncológicos. Estos animales pueden presentar complicaciones como hipotermia, hipoventilación, alteraciones hemodinámicas y dolor mal controlado, lo que afecta a su recuperación y calidad de vida. Un manejo adecuado en esta etapa reduce la morbilidad y facilita una recuperación más rápida y segura.
El dolor en pacientes oncológicos puede ser agudo, derivado del procedimiento quirúrgico, o crónico, asociado al crecimiento tumoral y la inflamación. Un control analgésico efectivo es esencial para mejorar el bienestar del paciente y prevenir complicaciones como la hiperalgesia o el dolor neuropático15.
El seguimiento a largo plazo es esencial en pacientes con cáncer. Es importante evaluar el control del dolor, la movilidad y el estado general del paciente para ajustar el tratamiento según sea necesario.
- Escalas de dolor: se pueden emplear herramientas como la Escala de Dolor de la Universidad de Glasgow para evaluar el bienestar del paciente.
- Revisión periódica: los controles veterinarios deben incluir ajustes en la analgesia, nutrición y cuidados paliativos cuando corresponda.
- Terapias complementarias: en algunos casos, técnicas como la acupuntura o la fisioterapia pueden contribuir a mejorar la recuperación.
Conclusiones y perspectivas futuras
El manejo anestésico en pacientes oncológicos es un desafío que requiere un enfoque individualizado y multidisciplinario. La evaluación preanestésica detallada, la selección de fármacos adecuados y una analgesia multimodal son esenciales para garantizar su seguridad y bienestar.
Es fundamental adaptar el protocolo anestésico a las condiciones clínicas del paciente, considerando su función cardiovascular, renal y hepática, así como el tipo y estadio del cáncer. Un abordaje personalizado minimiza riesgos y mejora la recuperación, mientras que el uso de estrategias multimodales de analgesia optimiza el control del dolor y reduce la morbilidad postquirúrgica.
Aún se requieren más investigaciones sobre el impacto de los anestésicos en la progresión tumoral y la función inmunitaria. Áreas clave incluyen el efecto de los fármacos inhalados en el crecimiento tumoral14, el desarrollo de nuevas estrategias analgésicas como los anticuerpos monoclonales y la optimización del monitoreo anestésico mediante tecnologías avanzadas.
Bibliografía:
- Steagall PV, Robertson SA. Concepts and applications of multimodal analgesia in veterinary medicine. Vet Clin North Am Small Anim Pract. 2018;48(5):995-1012.
- Murrell JC. Assessing and managing acute pain in dogs and cats. Vet Rec. 2020;187(4):135-140.
- Gironés R, Torregrosa D, Castells E. Beta-adrenergic signaling in cancer progression. J Mol Med. 2012;90(6):625-636.
- González-Cao M, Karachaliou N, Santarpia M, Viteri S, Teixidó C, Morales-Espinosa D, Rosell R. Role of angiogenesis in cancer therapy. Clin Transl Oncol. 2017;19(3):301-308.
- Coussens LM, Werb Z. Inflammation and cancer. Nature. 2002;420(6917):860-867.
- Ben-Eliyahu S. The promotion of tumor metastasis by surgery and stress: Immunological perspectives. Ann N Y Acad Sci. 2003;992:211-227.
- Snyder GL, Greenberg S. Effect of anesthetic technique and other perioperative factors on cancer recurrence. Br J Anaesth. 2010;105(2):106-115.
- Valverde A. Anesthetic management of the oncologic patient. Vet Clin North Am Small Anim Pract. 2016;46(4):677-690.
- Valverde A, Sinclair M. Advances in veterinary anesthesia. Vet J. 2021;273:105620.
- Gaynor JS, Muir WW. Handbook of veterinary pain management. 3rd ed. Mosby; 2020.
- Mathews KA, Kronen PW, Lascelles BD, et al. Guidelines for recognition, assessment and treatment of pain. J Small Anim Pract. 2014;55(6):E10-E68.
- Anderson SL, Duke-Novakovski T, Singh B. The immune response to anesthesia: Part 2 sedatives, opioids, and injectable anesthetic agents. Vet Anaesth Analg. 2014;41(6):553-66.
- Koepke EJ, Manning EL, Miller TE, Ganesh A, Williams DGA, Manning MW. The rising tide of opioid use and abuse: the role of the anesthesiologist. Perioper Med (Lond). 2018;7:16.
- Epstein M. AAHA anesthesia and monitoring guidelines for dogs and cats. J Am Anim Hosp Assoc. 2018;54(5):297-308.
- Monteiro BP, Lascelles BD, Murrell J, et al. Analgesia in veterinary oncology. Vet J.