Clara Alonso Araguas1, Ignacio Sández Cordero1,2
1Hospital Veterinario AniCura Vetsia, Leganés (Madrid)
2Universidad Europea de Madrid, Villaviciosa de Odón (Madrid)
Imágenes cedidas por los autores
El bloqueo epidural es una técnica analgésica frecuentemente empleada en medicina veterinaria. Consiste en administrar fármacos (generalmente anestésicos locales y/u opioides) a nivel extradural con el fin de que penetren en las raíces nerviosas y actúen en los procesos de modulación y transmisión medulares.
El uso del catéter epidural esta descrito tanto en medicina humana como en la clínica de pequeños animales para el manejo del dolor perioperatorio en cirugías abdominales, torácicas y traumatológicas1,2. Su empleo como control analgésico supone una menor demanda de fármacos sistémicos tanto a nivel intraoperatorio como posquirúrgico, con una buena recuperación y pocos efectos secundarios. Los beneficios asociados a esta técnica respecto a la técnica epidural convencional vienen derivados del avance de la punta del catéter hasta el lugar donde nacen los nervios que inervan la zona que se desea insensibilizar. Con ello se consigue el bloqueo de un menor número de raíces nerviosas, de manera que se reducen la dosis de anestésicos y los efectos adversos, así como prolongar su duración (mediante la administración repetida).
Descripción de la técnica
El acceso al espacio epidural para la colocación del catéter se puede realizar mediante distintos abordajes, entre los cuales el más habitual es el lumbosacro (L7-S1). Este abordaje permite reducir el riesgo de complicaciones respecto a otros más craneales (como lumbares o toracolumbares), debido a la menor probabilidad de punción medular en el perro a este nivel que en zonas más avanzadas. Sin embargo, tiene otras complicaciones potenciales derivadas de la distancia dentro del espacio epidural que tiene que recorrer el catéter. Se han descrito también abordajes caudales (sacro-coccígeo) tanto en el perro como en el gato, pero son menos frecuentes.
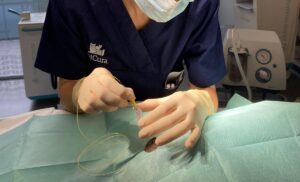
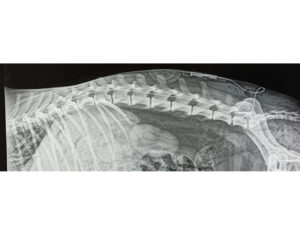
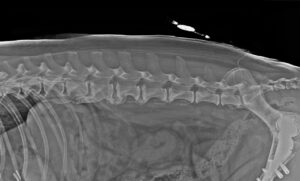
Para identificar el espacio lumbosacro se suele colocar al paciente en decúbito esternal con las extremidades posteriores extendidas cranealmente (lo cual permite una mejor exposición del punto de acceso) y se emplean las alas del íleon y la apófisis espinosa de L7 como referencias anatómicas mediante palpación (imagen 1 – ver galería más abajo). La zona ha de ser preparada de forma estéril con rasurado y lavado quirúrgico previo, y la técnica se realizará asépticamente. La aguja de elección será la Tuohy, ya que dispone de una punta menos lesiva y posee un mayor diámetro que facilita el paso del catéter. La entrada al espacio epidural se advierte una vez se atraviesa el ligamento amarillo por la pérdida de resistencia o mediante la técnica de gota-pendiente3, goteo continuo o running drip4, o mediante visualización ecográfica. Una vez localizado el espacio epidural se introduce el catéter y se avanza hasta el punto deseado (para ello se debe medir la distancia a introducir previamente) sin notar resistencia (imagen 2). Para facilitar el avance del catéter se pueden administrar pequeños bolos de suero salino fisiológico para conseguir una mayor apertura del espacio. Para comprobar la ubicación del catéter se pueden realizar diversas técnicas de diagnóstico por imagen: ecografía, radiografía con o sin contraste o fluoroscopia (imagen 3). En el extremo externo se debe poner un filtro antibacteriano (2 µm) y fijarlo a la piel. Finalmente se debe cubrir de forma estéril con un apósito y señalizarlo para facilitar su manejo en el periodo perioperatorio (imagen 4).
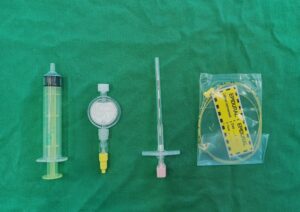
En lo que respecta a los tipos de catéteres que se pueden emplear, hay varias opciones comerciales. Existen diferentes calibres y dependiendo del tamaño del paciente se puede optar por un grosor u otro. El más frecuente es el de 20G, pero también se comercializan de 19G y 24G (imagen 5).
Existen kits que incluyen un fiador que discurre por el interior del catéter con el fin de aportar más firmeza y facilitar su avance por el espacio epidural (que se debe retirar una vez se alcance la posición deseada). También hay variedad de modelos con localización de los forámenes de salida para los fármacos, que influirán en la distribución de las soluciones que se administren. Existen presentaciones comerciales que presentan 3 orificios laterales, 6 orificios laterales o una única apertura en el extremo distal del catéter.
Contraindicaciones
En lo que respecta a las contraindicaciones asociadas a la técnica, vienen determinadas por el acceso al espacio epidural y por la administración de fármacos en este espacio. Entre ellas se incluyen: alteraciones en la coagulación, hipovolemia grave o inestabilidad hemodinámica marcada, septicemia, traumatismo en la zona, infección dermatológica en el punto de inyección, luxaciones, déficits neurológicos o trauma espinal.
Fármacos y dosificaciones
Los fármacos administrados a través del catéter son los comúnmente empleados en anestesia epidural, con modificaciones en la concentración y volumen (tabla 1). Principalmente se usan anestésicos locales y opioides, que habitualmente se administran combinados para potenciar sus efectos y duración3.
Tabla 1. Fármacos más empleados por el catéter epidural.
| Farmaco | Dosis | Duración | Periodo de latencia | Observaciones |
| Morfina | Perros y gatos 0,1 mg/Kg | 6-24 horas | 30-60 min | Puede provocar retención urinaria y prurito |
| Fentanilo | Perros 1-5 µg/Kg
Gatos 4 µg/Kg |
3-5 horas | 15-20 min | Poco empleado debido a su corta duración |
| Buprenorfina | Perros 3-5 µg/Kg
Gatos 4 µg/Kg |
16-24 horas | 60 min | No provoca retención urinaria |
| Dexmedetomidina | Perros y gatos 1-2 µg/Kg | 4-6 horas | 20-30 min | Efectos sistémicos dosis-dependientes |
| Medetomidina | Perros y gatos 5-10 µg/Kg | 2-6 horas | 20-30 min | Efectos sistémicos dosis-dependientes |
| Ketamina | 2 mg/Kg | 12 horas | Efecto antihiperalgésico. No disponible en España sin excipientes |
APUNTE CLÍNICO 1
Se debe tener en cuenta a la hora de posicionar la punta del catéter cuáles son las metámeras objetivo en función de la región anatómica que se desee insensibilizar. Las soluciones se desplazarán principalmente hacia craneal una vez sean administradas, por lo que el alcance del catéter epidural no serán necesariamente estas raíces nerviosas, sino que se dejará unas vértebras más caudales (tabla 2).
El avance del catéter por el espacio epidural a veces puede mostrar una ligera resistencia, por lo que se pueden administrar pequeños bolos de suero salino fisiológico. Una vez que se retire la aguja Tuohy no se puede avanzar más. Es por ello por lo que la recomendación es introducir unos centímetros de más para compensar posibles bucles, y retirar más tarde en caso de haber avanzado demasiado.
Es importante no retirar el catéter con la aguja Tuohy todavía en el espacio epidural, ya que existe más riesgo de que este se rompa con el filo de la aguja.
Tabla 2. Distribución y alcance aproximado de los anestésicos en el espacio epidural.
| Cirugía | Posición punta catéter | Alcance raíces nerviosas |
| Trauma 1/3 posterior | L6 | Alcance aproximado entre L2-L7 |
| Abdomen medio | L1 | Alcance hasta T9-L3 |
| Abdomen craneal | T9 | Alcance hasta T5-T10 |
| Tórax caudal | T9 | Alcance hasta T5-T10 |
Anestésicos locales
Los anestésicos locales difunden a través de la duramadre para actuar en las raíces nerviosas y en la médula espinal bloqueando los canales de sodio de las membranas celulares. Al tratarse de fármacos con propiedades lipofílicas, pueden ser rápidamente absorbidos por vía sistémica.
Sus efectos deben monitorizarse de cerca para controlar el nivel de analgesia y los efectos secundarios, y ajustar en consecuencia la dosificación. La técnica del catéter epidural permite reducir las concentraciones de estos fármacos, lo cual permite conseguir un bloqueo sensorial selectivo con la mínima afectación motora5.
Dosificación de anestésicos locales
Según peso
La dosificación de los anestésicos locales se puede realizar en función del peso del paciente, con un rango de entre 0,1 y 0,2 mL/kg3.
Según la longitud occipito-coccígea
En el caso de la dosificación por longitud occipito coccígea3 (LOC, tomada desde el cóndilo occipital hasta la primera vértebra coccígea), se debe tener en cuenta la distribución del volumen por la columna, ya que dependiendo de la cantidad de mililitros que se administren se bloqueará un porcentaje u otro de su longitud total. De este modo:
- Administrando 0,05 mL/cm de LOC bloquearán entre el 30-35 % de la LOC.
- Administrando 0,1 mL/cm de LOC bloquearán entre el 55-60 % de la LOC.
- Administrando 0,15 mL/cm de LOC bloquearán entre el 70-75 % de la LOC.
En el caso de los catéteres epidurales, al poder avanzar la punta de este hasta las metámeras objetivo, se suele emplear una dosis baja (es decir 0,05 mL/cm LOC) para no bloquear un porcentaje muy elevado de la cadena ganglionar simpática. Este volumen bloquea aproximadamente 8 metámeras en total: 5 cranealmente y 3 caudalmente. Hay estudios que demuestran que alcanzar los cuerpos vertebrales de T3 puede suponer un menor nivel analgésico torácico y mayores complicaciones, como parálisis laríngea6. Por lo tanto, no se debería subir la punta del catéter más craneal de la vértebra T8.
Es muy importante el manejo posquirúrgico, tanto la evaluación de los efectos analgésicos como la aparición de efectos adversos, ya que es posible que haya que modificar dosis y concentraciones en función de las necesidades específicas de cada caso. Para ello se debe evaluar el dolor mediante escalas validadas. Por último, se debe tener en cuenta que, a mayores concentraciones y mayores volúmenes de fármaco, mayor duración y mejor distribución, pero también mayor tasa de efectos adversos7.
APUNTE CLÍNICO 2
Se debe tener en cuenta que cuanto más craneal sea la localización del catéter, más riesgo habrá de bloquear raíces torácicas y mayor riesgo de depresión ventilatoria, especialmente por bloqueo de los músculos intercostales. Sin embargo, el bloqueo del nervio frénico y, por tanto, del diafragma es más complicado que ocurra ya que está inervado por raíces nerviosas más craneales aún (cervicales) y generalmente no se avanza tanto el catéter epidural. Para reducir el bloqueo motor de los músculos intercostales en pacientes despiertos se pueden emplear concentraciones bajas de anestésicos locales (por ej., bupivacaína 0,125 %-0,25 %).
Tipos de anestésicos locales
Bupivacaína
La bupivacaína es el anestésico local con mayor duración (4 – 6 horas) y mayor periodo de latencia (entre 15 y 25 minutos). Debido a que su administración en pacientes despiertos puede provocar sensación dolorosa en el momento de la inyección, se recomienda una velocidad de administración lenta para disminuir este efecto.
En lo que respecta a la concentración de este agente, los rangos oscilan entre el 0,125 y el 0,5 %. La concentración del principio activo determinará la intensidad del bloqueo nervioso: soluciones de bupivacaína al 0,5 % producen un bloqueo completo motor, sensitivo y de la cadena ganglionar simpática, mientras que la bupivacaína al 0,125 % produce un menor bloqueo sensitivo, pero también menor bloqueo motor y de cadena ganglionar.
En el caso de las infusiones continuas, las publicaciones indican bupivacaína 0,125-0,25 % a una velocidad de 0,02-0,05 ml/Kg/hora3.
Lidocaína
Se trata de otro anestésico local con un periodo de acción más corto y un periodo de latencia menor. Es por ello por lo que se emplea con menos frecuencia que la bupivacaína, ya que uno de los objetivos del empleo del catéter epidural es el manejo analgésico durante periodos más largos. Algunos artículos describen una duración de 30 minutos a nivel torácico8.
Complicaciones
Asociadas a la administración de fármacos en el espacio epidural
La principal complicación dentro de este grupo es la hipotensión, asociada generalmente al bloqueo por parte de los anestésicos locales de la cadena ganglionar simpática. Sus efectos vienen determinados por una disminución en las resistencias vasculares sistémicas y/o del gasto cardíaco. Estos efectos se ven determinados por la altura a la que se realice el bloqueo y por la extensión de este (a mayor volumen de anestésico mayor extensión). Así, bloqueos de la región lumbar y de la región torácica caudal están más asociados a una disminución de las resistencias vasculares sistémicas; mientras que disminuciones del gasto cardiaco secundarias a bradicardias aparecen cuando los fármacos se distribuyen o migran a niveles torácicos más altos (T1-T5). Esto último se debe tener en cuenta cuando la punta del catéter queda por delante de T9 (algo poco habitual en la práctica clínica).
Los vómitos también están descritos como efectos adversos, y parecen estar relacionados con la velocidad de administración de los fármacos y más asociados a los opioides. Ciertas publicaciones recomiendan administraciones durante 5 minutos para evitar su aparición, y se puede controlar con manejo médico como con el uso de maropitant9.
La debilidad motora es una complicación frecuente en esta técnica, y se puede reducir administrando concentraciones bajas de anestésicos y más espaciadas en el tiempo si fuese necesario2.
La retención urinaria también está descrita con relativa frecuencia, generalmente secundaria a la administración de morfina por sus efectos sobre el músculo detrusor. En la mayor parte de las ocasiones se resuelve de forma espontánea, pero debe tenerse en cuenta en animales con patología del sistema urinario. Una alternativa a la morfina puede ser el empleo de buprenorfina, que tiene una duración y un efecto analgésico similar cuando se administran por vía epidural en dosis bajas y con menor incidencia descrita de retención urinaria3.
Otros efectos secundarios como prurito, infecciones, o dermatitis también han sido descritos con menores porcentajes.
Derivadas de la colocación del catéter
La complicación asociada a la técnica del catéter epidural con mayor incidencia, descrita tanto en medicina humana como en veterinaria, es la salida accidental del catéter1, con un mayor porcentaje en cirugías traumatológicas por fracturas y con una incidencia entre el 13 y el 20 %.
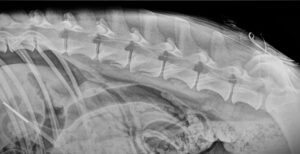
También está descrita la aparición de bucles en el canal epidural2, especialmente en catéteres que son introducidos sin fiador (imágenes 6 y 7).
Por último, el síndrome de Horner10 también ha sido descrito como complicación asociada a esta técnica, debido a la acción de los fármacos sobre dermatomas cervicales. Este efecto es transitorio.
Casos clínicos
A continuación, se presenta la revisión de 63 casos clínicos realizados en nuestro hospital veterinario desde abril de 2018 hasta diciembre de 2024 en los que se empleó un catéter epidural como protocolo analgésico perioperatorio. Entre las cirugías se incluyeron: 24 cirugías hepáticas, 21 toracotomías, 10 adrenalectomías, 2 toracotomías junto con laparotomía, 2 cirugías pancreáticas, 2 laparotomías exploratorias y 2 cirugías traumatológicas (vídeo 1).
Vídeo 1
El rango de peso de los pacientes osciló entre los 4,5 Kg hasta los 50 Kg, el de edad entre los 2 y 16 años y todos los pacientes fueron clasificación ASA II o III. Uno de los pacientes falleció intraoperatorio y otro falleció en la hospitalización, ambos por causas no relacionadas con el protocolo de anestesia y analgesia.
En todos los pacientes se realizó un abordaje lumbosacro para la colocación del catéter epidural, y la comprobación de la entrada en el espacio se realizó mediante la técnica gota pendiente o técnica de running-drip. La verificación del correcto posicionamiento del catéter y del alcance de este se realizó mediante radiografía pre o posoperatoria o por fluoroscopia durante la colocación de este.
La dosificación se realizó acorde a la LOC con una dosis de 0,05 mL/cm de bupivacaína en una concentración entre el 0,5-0,25 % en el periodo intraoperatorio (bajo criterio del veterinario clínico responsable) y 0,125-0,25 % en el posoperatorio según la demanda del paciente, cada 6-8 horas. Además, todos los pacientes recibieron morfina en dosis de 0,1 mg/Kg cada 24 horas.
De los 36 casos clínicos de los que se ha recuperado el registro anestésico, 10 necesitaron rescate analgésico intraoperatorio (fentanilo 2-5 µg/Kg) (considerando respuesta simpática a un estímulo nociceptivo un incremento del 20 % en la frecuencia cardiaca o presión arterial). También se presentaron otro tipo de complicaciones a nivel hemodinámico como bradicardia (3 casos, tratada con atropina 10-20 µg/Kg) e hipotensión (5 casos, manejada con fluidoterapia cuando la sospecha de la causa era hipovolemia o con vasopresores cuando la sospecha era vasodilatación). Las complicaciones hemodinámicas no se pueden asociar exclusivamente al empleo de fármacos anestésicos por el catéter epidural.
En lo que respecta a las complicaciones asociadas a la colocación del catéter, se registraron 11 bucles (17 % del total). Todos ellos entre L5-L7. En estos pacientes la colocación final de la punta del catéter determinó la valoración de la efectividad de la técnica. Por ello, en los casos en los que se consideró que la punta estaba muy caudal y la distribución de los fármacos no iba a ser efectiva, se retiró el catéter (5 casos, 45 % de los casos con bucles). Sin embargo, hubo pacientes en los que, a pesar de presentar bucles, el catéter avanzó lo suficiente como para considerar que se podría obtener una buena cobertura analgésica (6 casos, 55% de los casos con bucles).
Durante la hospitalización también se presentaron otros efectos secundarios asociados al catéter, que se recogen en la tabla 3.
| Complicación | Número de casos | Porcentaje | Comentarios |
| Retención urinaria | 4 | 6 % | Resolución espontánea |
| Vómitos | 3 | 5 % | Manejo con antieméticos |
| Pérdida temporal de la consciencia | 2 | 3 % | Asociados a la administración. Manejo con mayores diluciones y administraciones más lentas. |
| Debilidad del tercio posterior | 8 | 13 % | Mayor dilución del anestésico local |
| Salida accidental del catéter | 4 | 6 % | |
| Horner | 2 | 3 % | Resolución espontánea |
La evaluación del dolor postoperatorio se realizó mediante la Escala Compuesta de Valoración de dolor de Glasgow (GCPS-SF) al menos 2 horas después de la extubación y cada 4 horas hasta la retirada del catéter, que según cada caso se realizó entre 24 y 72 horas después de la cirugía. Exceptuando los casos en los que existiera contraindicación clínica, los pacientes recibieron refuerzo analgésico sistémico con meloxicam (0,1 mg/Kg/24 horas, un total de 52 pacientes) y paracetamol (10-15 mg/Kg/8 horas, un total de 34 pacientes). Un total de 9 pacientes (14 %) necesitaron analgesia de rescate postoperatoria (valor en escale de Glasgow superiores a 6/24), con metadona (0,1-0,2 mg/Kg) o incrementando la concentración del anestésico local (subiendo de 0,125 % a 0,25 %).
APUNTE CLÍNICO 3
La tasa de aparición de bucles descrita en la bibliografía es menor a nuestra experiencia. Además, hemos observado que no existe una relación directa entre la longitud de catéter introducido y la presencia o no de estos bucles, ya que la mayor parte de ellos se producen en las últimas vértebras lumbares (entre L5-L7 aproximadamente), es decir, muy cerca del punto de abordaje (a nivel lumbosacro), y no en vértebras lumbares craneales o torácicas. La explicación a este fenómeno se puede deber, por un lado, a que las vértebras lumbares más caudales presentan un espacio epidural de mayor tamaño; por otro lado, a pesar de que en veterinaria aún no está demostrado, en medicina humana está descrita la presencia de los ligamentos meningo-vertebrales en las vértebras lumbares, encargados de anclar la duramadre a la pared del canal espinal. Hay autores que sugieren una posible relación entre la presencia de estos ligamentos y la lateralización tanto de las soluciones anestésicas como de los propios catéteres.
En ninguno de los casos que presentaron bucles hubo complicaciones en la retirada de estos (vídeo 2).
Vídeo 2
Conclusiones
Como conclusión, el catéter epidural puede resultar una herramienta analgésica eficaz que permite un buen control del dolor perioperatorio y reducir el uso de fármacos analgésicos sistémicos. En la serie de casos clínicos que se presentan, la incidencia de complicaciones graves es baja, y están principalmente relacionadas con los efectos cardiovasculares y motores de los anestésicos locales y con la colocación del catéter.
Bibliografía:
- Swalander, D.B., et al., Complications associated with the use of indwelling epidural catheters in dogs: 81 cases (1996-1999). J Am Vet Med Assoc, 2000. 216(3): p. 368-70.
- Hansen BD. Epidural catheter analgesia in dogs and cats: technique and review of 182 cases (1991–1999). J Am Anim Hosp Assoc. 2001;37(1):69–82.
- Read, M. R., Campoy, L., & Fischer, B. (Eds.). (2024). Small animal regional anesthesia and analgesia. John Wiley & Sons.
- Martinez-Taboada F, Redondo JI. Comparison of the hanging-drop technique and running-drip method for identifying the epidural space in dogs. Vet Anaesth Analg. 2017 Mar;44(2):329-336.
- Steagall PVM, Simon BT, Teixeira Neto FJ, Luna SPL. An Update on Drugs Used for Lumbosacral Epidural Anesthesia and Analgesia in Dogs. Front Vet Sci. 2017 May 12;4:68
- Son WG, Jang M, Jo SM, Kim H, Shin CW, Lee I. Cranial versus caudal thoracic epidural anesthesia using three volumes of lidocaine in conscious Beagle dogs. Vet Anaesth Analg. 2019 Jan;46(1):96-105.
- Gomez de Segura IA, Menafro A, García-Fernández P, Murillo S, Parodi EM. Analgesic and motor-blocking action of epidurally administered levobupivacaine or bupivacaine in the conscious dog. Vet Anaesth Analg. 2009 Sep;36(5):485-94
- DeRossi R, Frazílio FO, Jardim PH, Martins AR, Schmidt R, Negrini-Neto JM. Evaluation of thoracic epidural analgesia induced by lidocaine, ketamine, or both administered via a lumbosacral approach in dogs. Am J Vet Res. 2011 Dec;72(12):1580-5.
- Mathis A, Lee K, Alibhai HI. The use of maropitant to prevent vomiting induced by epidural administration of preservative free morphine through an epidural catheter in a dog. Vet Anaesth Analg. 2011 Sep;38(5):516-7.
- Bianchi C, Stathopoulou TR. Transient unilateral Horner’s syndrome after epidural catheter administration of bupivacaine in a dog. Vet Anaesth Analg. 2021 Jul;48(4):628-629.