Eva Mohr Peraza1, Jorge Isidoro Matos Rivero1,2, Alexis Santana González2, José Alberto Montoya Alonso1, Elena Carretón Gómez1
1 Medicina interna, Facultad de Medicina Veterinaria, Instituto de Investigación en Ciencias Biomédicas y de la Salud (IUIBS), Universidad de Las Palmas de Gran Canaria
2 AniCura Albea, Las Palmas de Gran Canaria
Imágenes cedidas por los autores
El hurón (Mustela putorius furo) es un pequeño mamífero carnívoro de la familia de los mustélidos, clasificado como una mascota exótica o nuevo animal de compañía (NAC). Su popularidad como mascota ha crecido notablemente en los últimos años, debido a su naturaleza social y a la fuerte conexión que tiende a desarrollar con sus tutores1.
Por ello, se están llevando a cabo investigaciones en patologías en esta especie que ya están sobradamente estudiadas en otras mascotas como perros y gatos. Concretamente, en el caso de la dirofilariosis, estudios recientes han demostrado que los hurones tienen una elevada susceptibilidad a infectarse por Dirofilaria immitis, especialmente aquellos que viven en áreas endémicas.
Aunque los hurones no son un hospedador ideal para el gusano del corazón, sí son capaces de completar su ciclo biológico, de manera similar a los perros2. Los estudios sugieren que los hurones tienen una susceptibilidad del 100 % a infecciones experimentales con larvas de tercer estadio (L3), lo cual es comparable a la susceptibilidad de los perros. Sin embargo, su tasa de recuperación, que varía entre el 34 % y el 54 %, es sensiblemente inferior a la de los perros, aunque superior la de los gatos infectados con parásitos adultos3. Esto es así porque la presencia de un solo gusano del corazón puede desencadenar problemas cardiacos graves; se han registrado casos de insuficiencia cardiaca derecha mortal en hurones infectados con apenas dos gusanos adultos, principalmente debido a la obstrucción mecánica del flujo sanguíneo4.
Signos clínicos
Los signos clínicos en los hurones son similares a los descritos en perros y gatos; varían desde animales asintomáticos hasta aquellos con insuficiencia cardiaca congestiva derecha e incluso muerte súbita5. Los signos clínicos comúnmente descritos incluyen letargia, tos, inapetencia, disnea, cianosis, intolerancia al ejercicio, derrame pleural, ascitis y paresia de las extremidades posteriores6,7. También se ha observado soplo sistólico en hurones con dirofilariosis, principalmente por la afección de la válvula tricúspide. Esta condición puede producir hemólisis intravascular y, en casos graves, llevar a la insuficiencia hepática y renal aguda5. Otros hallazgos clínicos reportados incluyen tromboembolismo pulmonar, arteritis pulmonar grave y neumonía eosinofílica o granulomatosa6.
En los perros, el síndrome de cava causado por el gusano del corazón se caracteriza por la presencia de hemoglobina en la orina. En los hurones, se presenta la ruptura de eritrocitos, liberando moléculas del grupo hemo; la biliverdina, un producto de descomposición hemática, puede encontrarse tanto en la sangre como en la orina de los hurones infectados8. La hemoglobinuria y la bilirrubinuria han sido reportadas en análisis de orina en hurones con altas cargas parasitarias6,7. Las anormalidades hematológicas observadas incluyen monocitosis y anemia, así como eosinofilia y neutrofilia7.
Diagnóstico
Detección de microfilarias
Frotis de sangre o “gota gruesa”
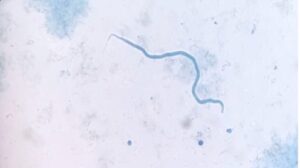
Esta técnica consiste en observar una gota de sangre bajo el microscopio para buscar la presencia de microfilarias (imagen 1). En hurones, esta técnica puede ser menos efectiva debido a la baja carga parasitaria (generalmente presentan uno o dos parásitos adultos) y, por tanto, es menos probable que presenten microfilarias en sangre circulante o bien su presencia será en baja concentración.

Test de Knott modificado
Al tratarse de una técnica de concentración, el test de Knott modificado permite detectar la presencia de microfilarias con mayor sensibilidad, por lo que es el método de elección a la hora de examinar en busca de microfilarias. Además, también es el método de elección para realizar el examen morfológico de la microfilaria. Se trata de una técnica muy sencilla y rápida que únicamente requiere formol, azul de metileno y una centrífuga (imagen 2). Puede verse un tutorial en la página web de la Sociedad Europea de Dirofilariosis y Angiostrongilosis (www.esda.vet).
Detección de antígenos
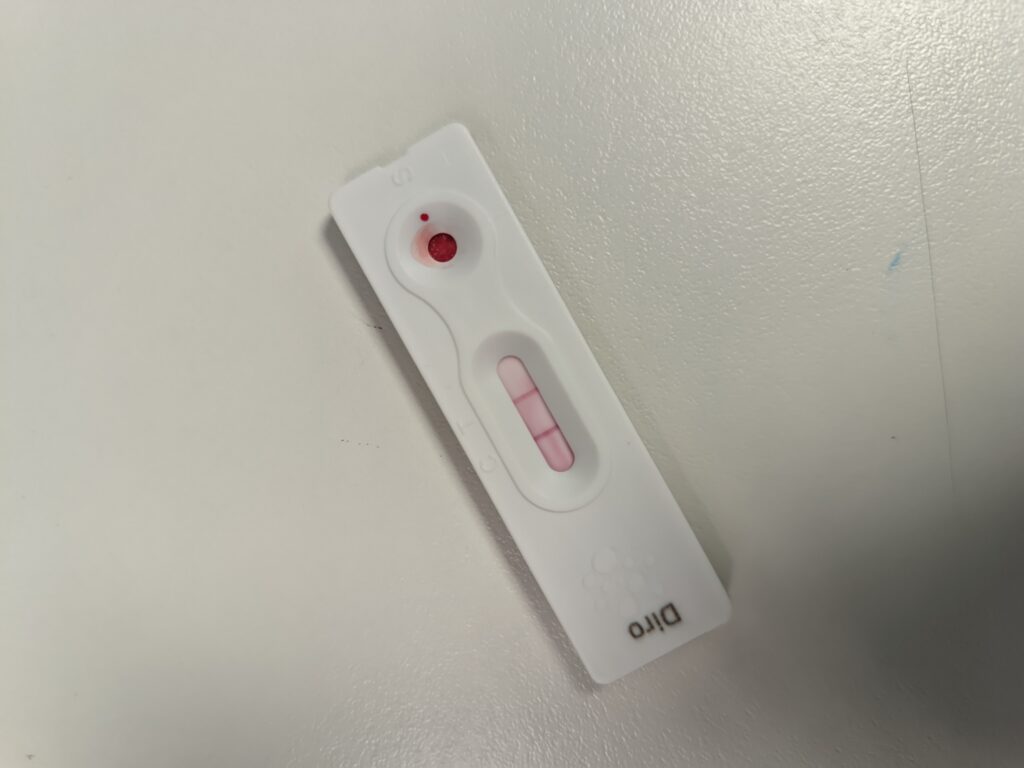
Los kits de detección comercial de antígenos, generalmente empleados en dirofilariosis canina, se han utilizado con éxito en hurones y han demostrado buena efectividad cuando el animal lleva más de 5 meses infectado (imagen 3).
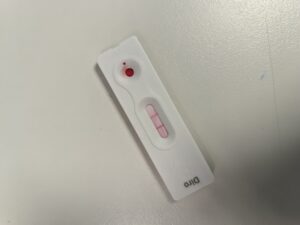
Aunque son eficaces, su sensibilidad es variable en las etapas tempranas de la infección. En hurones infectados experimentalmente, la tasa de detección mediante antígenos ha mostrado una variabilidad de entre el 40 % y el 80 % a los 4 meses de la inoculación3.
Estas pruebas pueden ser útiles para el diagnóstico inicial, pero se recomienda confirmación mediante otras técnicas complementarias.
Detección de anticuerpos
En la actualidad se está estudiando la validez de la detección de anticuerpos frente a D. immitis en hurones, con valores de sensibilidad y especificidad, mediante técnicas de ELISA, al igual que se ha desarrollado en la dirofilariosis felina. Sin embargo, como con otras pruebas inmunológicas, puede tener limitaciones en las primeras etapas de infección y todavía se encuentra en fases de investigación.
Diagnóstico por imagen
Radiografía torácica
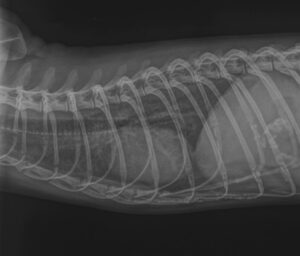
La radiografía torácica es una herramienta valiosa para evaluar cambios en la morfología del corazón y los vasos sanguíneos en hurones infectados por D. immitis (imagen 4). La presencia de signos de agrandamiento del ventrículo derecho y dilatación de las venas cavas es indicativa de una carga parasitaria significativa que estaría afectando a la estructura cardiopulmonar. Las radiografías torácicas también pueden revelar signos de congestión pulmonar o patrón vascular pulmonar, lo cual respaldaría la sospecha de infección7.
La radiografía es útil como prueba inicial para orientar el diagnóstico diferencial, y también para determinar el grado de gravedad del hurón previamente diagnosticado.
Ecocardiografía
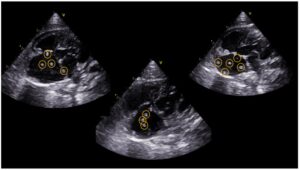
La ecocardiografía es el método de elección para el diagnóstico definitivo de la infección por D. immitis en hurones junto con el test de antígenos.
Esta técnica de ultrasonido permite visualizar directamente los gusanos adultos en las cavidades del corazón y los grandes vasos, como la arteria pulmonar, el ventrículo y la aurícula derechos (imagen 5). En el ecocardiograma, los parásitos se observan como estructuras lineales y paralelas que producen una señal ecogénica en el flujo sanguíneo.
Este examen es altamente específico y permite una evaluación detallada de la carga parasitaria y su impacto en la función cardiaca, brindando información esencial para el manejo clínico.
Tomografía computarizada (TC)
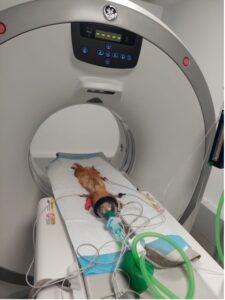
Aunque la TC no es comúnmente utilizada para diagnosticar dirofilariosis en el ámbito clínico debido a su coste y accesibilidad limitada, puede ser útil en casos complejos o cuando otras pruebas no ofrecen suficiente información. La TC permite una visualización en tres dimensiones del corazón y los vasos sanguíneos, facilitando la identificación de anomalías estructurales y proporcionando una evaluación más precisa de la extensión de la enfermedad (imagen 6). Esta técnica también puede ayudar a planificar intervenciones terapéuticas en casos avanzados.
Tratamiento
En la actualidad, no hay un tratamiento adulticida aprobado, ni ningún tratamiento farmacológico que sea seguro y eficaz para los hurones infectados por D. immitis. Se ha utilizado el dihidrocloruro de melarsomina en estos animales, pero la tasa de supervivencia es alarmantemente baja, inferior al 50 %. Este tratamiento conlleva un riesgo elevado de muerte súbita por tromboembolismo tras la muerte de los parásitos, lo que desaconseja su uso2,6. Otros estudios con ivermectina y otras lactonas macrocíclicas, como la moxidectina subcutánea, han demostrado poca seguridad o bien se encuentran en desarrollo9,10.
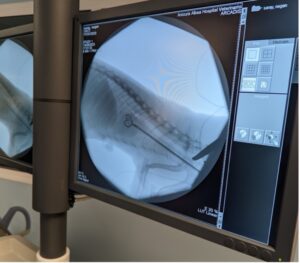
Como alternativa a las opciones farmacológicas, se han documentado dos casos de extracción quirúrgica de parásitos (imágenes 7 y 8):
- En el primero, se extrajeron tres gusanos adultos utilizando una cesta de recuperación a través de la vena yugular derecha, alcanzando la vena cava caudal y la aurícula derecha con guía fluoroscópica. Sin embargo, no se logró retirar todos los parásitos, por lo que el hurón requirió tratamiento de apoyo a largo plazo8.
- En el caso más reciente, se pudo extraer la totalidad de los parásitos presentes (dos gusanos adultos) mediante la misma técnica11.
La extracción quirúrgica supera las limitaciones de los tratamientos farmacológicos, ya que ofrece una alternativa viable y segura, garantizando la eliminación completa de los parásitos y reduciendo el riesgo de complicaciones graves.
Prevención
El control de la infección se logra mediante la administración mensual de un preventivo rutinario contra el gusano del corazón. Esto incluye la administración mensual de ivermectina (0,05 mg/kg, vía oral), milbemicina oxima (1,15–2,33 mg/kg, vía oral), selamectina (6–18 mg/kg, de forma tópica) o una combinación de imidacloprid al 10 % y moxidectina al 1 % (0,4 mL/hurón, de forma tópica)4 [6, 9, 10].
Referencias:
- Williams B.H. Therapeutics in ferrets. Vet Clin North Am Exot Anim Pract. 2000; 3:131 – 153
- Van Zeeland, Y.R.; Schoemaker, N.J. Ferret cardiology. Vet. Clin. Exot. Anim. 2022, 25, 541–562.
- McCall J. W. Dirofilariasis in the domestic ferret. Clin tech small ani pract. 1998; 13: 109–112.
- American Heartworm Society. (s.f.). Heartworm in Ferrets. (https://www.heartwormsociety.org/pet-owner-resources/heartworm-basics/14-pet-owner-resources/567-heartworm-in-ferret)
- Sasai H., Kato K., Sasaki T., Koyama S., Kotani T., Fukata T. Echocardiographic diagnosis of dirofilariasis in a ferret. J Small Anim Pract. 2000; 41:172-174.
- Antinoff, N. Clinical observations in ferrets with naturally occurring heartworm disease and preliminary evaluation of treatment with ivermectin with and without melarsomine. In Proceedings of the Triennial Symposium of American Heartworm Society, Philadelphia, PA, USA, 23–26 July 2001.
- Supakorndej, P.; Lewis, R.E.; McCall, J.W.; Dzimianski, M.T.; Holmes, R.A. Radiographic and angiographic evaluations of ferrets experimentally infected with Dirofilaria immitis. Vet. Radiol. Ultrasound 1995, 36, 23–29.
- Bradbury, C.; Saunders, A.B.; Heatley, J.J.; Gregory, C.R.; Wilcox, A.L.; Russell, K.E. Transvenous heartworm extraction in a ferret with caval syndrome. J. Am. Anim. Hosp. Assoc. 2010, 46, 31–35.
- Cottrell, D.K. Use of moxidectin (ProHeart 6) as a heartworm adulticide in 4 ferrets. Exot. DVM 2004, 5, 9–12.
- Schaper, R.; Heine, J.; Arther, R.G.; Charles, S.D.; McCall, J. Imidacloprid plus moxidectin to prevent heartworm infection (Dirofilaria immitis) in ferrets. Parasitol. Res. 2007, 101, 57–62.
- Mohr-Peraza, E., Matos, J. I., García-Rodríguez, S. N., Santana-González, A. J., Carretón, E., & Montoya-Alonso, J. A. (2024). Successful Transvenous Extraction of Adult Dirofilaria immitis Parasites from a Naturally Infected