Pablo Monroy Morales1, María Coego Montoto1, Adriana Gómez Pérez1, Alexis J. Santana González2, Susana Serrano Sobrino3.
1Miembro del Servicio de Cardiología de AniCura Vetsia Hospital Veterinario.
2Responsable del área de cardiorrespiratorio, cirugía torácica y terapia endovascular de AniCura Albea.
3Responsable del Servicio de Cardiología de AniCura Vetsia Hospital Veterinario.
Imágenes cedidas por Alexis J. Santana y AniCura Vetsia Hospital Veterinario
La cardiología intervencionista es una subespecialidad de la medicina cardiovascular que consiste en la cateterización mínimamente invasiva del corazón desde los vasos sanguíneos periféricos guiada por fluoroscopia. Estas intervenciones pueden incluir la dilatación con balón de válvulas o vasos estenosados, la oclusión con dispositivos de lechos vasculares enfermos o vasos anómalos, la implantación de stents para lúmenes estrechados o bloqueados, la biopsia o extracción de tumores o material extraño en el corazón y los vasos sanguíneos, entre otras1.
La utilización de este tipo de técnicas es más frecuente en patologías cardiacas congénitas, aunque cada vez más, se están desarrollando técnicas para otro tipo de patologías cardiacas adquiridas. A continuación, se hará una breve revisión de las principales intervenciones realizadas en cardiología veterinaria.
Valvuloplastia pulmonar con balón (VPB)
La estenosis congénita de la válvula pulmonar es común en perros, sobre todo en razas braquicéfalas: es la enfermedad cardiaca congénita más común en estos animales según varios estudios2,3. Entre los síntomas encontramos intolerancia al ejercicio, síncopes, muerte súbita, insuficiencia cardiaca congestiva (ICC), etc. (tabla 1).
Tabla 1. Clasificación de los tipos de estenosis pulmonar según morfología4
| Tipos de estenosis pulmonar (EP) según morfología | |
| EP tipo A | EP tipo B |
| Fusión de las comisuras | Engrosamiento de las valvas |
| Doming sistólico | Hipoplasia del anillo (Ratio AO/AP > 1,2) |
| Ratio AO/AP < 1.2 | Grave hipertrofia infundibular |
| Dilatación post estenótica | |
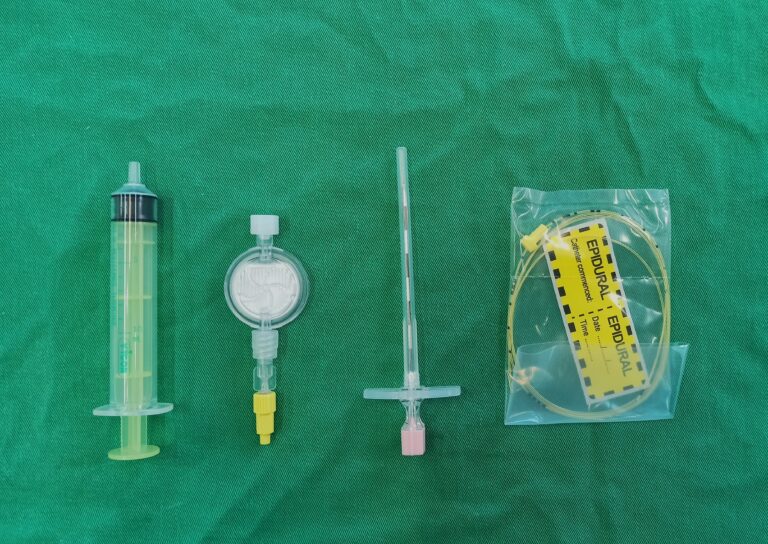
Se ha demostrado que la valvuloplastia mejora los síntomas y aumenta la esperanza de vida de los pacientes. A través de un abordaje percutáneo por la vena yugular o femoral, se cateteriza la vena y se coloca un introductor para tener una vía de acceso. Con la utilización de una guía y catéter de angiografía se avanza hasta la arteria pulmonar y se realiza una angiografía selectiva con el soporte de fluoroscopia para determinación del balón que se debe utilizar y evaluar la morfología de la válvula y del tracto de salida del ventrículo derecho (VD). Es imprescindible medir presiones intracardiacas pre y post a la dilatación con balón. La ratio balón – anillo suele ser entre 1.2 y 1.4 (imagen 1 – clic para ampliar). Una vez seleccionado el balón idóneo, se retira el catéter y, manteniendo la guía, se avanza con el balón hasta la zona de la estenosis. Lo ideal es colocar la zona central del balón en la zona de estenosis para conseguir una mejor estabilización y una dilatación más eficiente. Con ayuda de un manómetro para controlar la presión ejercida y con una mezcla de suero y contraste radiopaco se procede a inflar el balón, que no deberá superará los 5 – 6 segundos.
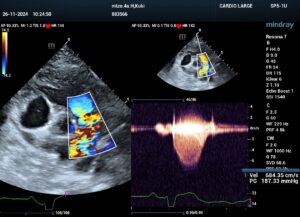
Normalmente se realizan de 2 – 4 inflaciones para asegurar una correcta dilatación esperando entre 5 – 10 minutos entre cada para permitir la recuperación del paciente. Una vez realizada la valvuloplastia, se realiza de nuevo una determinación de presiones intracardiacas para valorar la disminución y el éxito de la intervención. Se considera que el procedimiento ha sido satisfactorio cuando se consigue una reducción del 50 % del gradiente o gradientes < 30 – 40 mmHg. Se retira todo el material, incluido el introductor, y se logra la hemostasia con una sutura de bolsa alrededor del sitio de acceso, además de 5 minutos de presión (vídeo 1).
Como consideraciones especiales, es importarte descartar la presencia de alteraciones coronarias que puedan aumentar el riesgo de la cirugía, sobre todo en razas braquiocefálicas5.
Vídeo 1
Valvuloplastia pulmonar con balón de alta presión
En las últimas décadas, ha habido un avance considerable en el diseño de balones endovasculares impulsado por la necesidad de tratar de manera efectiva la enfermedad vascular periférica en personas. Específicamente, los pacientes humanos y caninos que carecen de la válvula delgada y fusionada de la EP tipo A pueden beneficiarse de catéteres de dilatación con balones alternativos, ya que los estudios sugieren que los pacientes con displasia valvular y un anillo hipoplásico tienen menos mejoría después de la valvuloplastia con balones de baja presión, así como un pronóstico peor6-8. La VPB de alta presión se define como una presión de inflación del balón de al menos 8 atm.
Un estudio sobre la VPB de alta presión en 25 perros demostró éxito en el procedimiento en el 92 %, incluidos nueve perros considerados con válvulas tipo B o displásicas9. Después de ese estudio, otros autores publicaron los resultados de 20 perros sometidos a BPV de baja presión (definida como <4 atm), en los cuales el 60 % mostró éxito en el procedimiento y no se observó efecto del tipo de válvula (A o B)45.
Dilatación con balón de corte para la displasia de la válvula pulmonar
La dilatación con balón alivia la estenosis valvular al desgarrar las valvas fusionadas o engrosadas. El estiramiento logrado con la dilatación con balón puede no ser suficiente para desgarrar tejido muy grueso y fibroso. Sin embargo, existen catéteres que, cuando se inflan, exponen pequeñas microcuchillas que cortan el tejido al extenderse desde la superficie del balón.
La técnica de dilatación con balón de corte requiere equipo adicional y mayor coste en comparación con la VPB estándar. Se recomienda una inflación y desinflación gradual (óptimamente 60 segundos) para exponer adecuadamente y luego volver a plegar las microcuchillas durante la dilatación; esta implementación gradual puede no ser factible en la EP, ya que el gasto cardiaco puede verse comprometido cuando el balón está inflado.
Un desafío adicional es que los tamaños disponibles de los balones de corte están limitados a un diámetro máximo de 8 mm, lo que puede no ser lo suficientemente grande para involucrar la válvula en todos los casos de EP canina, particularmente en perros grandes. Finalmente, los pequeños diámetros de los balones de corte significan que las presiones nominales y de ruptura se alcanzan con mucho menos volumen que los balones típicos utilizados para la VPB. Si el operador no es consciente de esta rápida inflación, es fácil superar la presión de ruptura, lo que puede resultar en la avulsión de una micro cuchilla, lo que causaría trauma vascular.
Implantación de stent transpulmonar
La implantación de stent puede proporcionar un enfoque terapéutico alternativo para los perros que no responden a la VPB. El valor de la implantación del stent es mantener físicamente el tejido displásico (válvula gruesa, adherencias fibrosas) al lado del tracto de salida, mejorando así el flujo hacia adelante. En contraste con la VPB, esta técnica deja un implante en el paciente, lo que puede ser positivo (previniendo la re-estenosis) o negativo (si se fractura o es reactivo) (imagen 2).
En los últimos 5 años, el servicio de Cardiología de la Universidad de Colorado, Estados Unidos, ha implantado 64 stents en perros para EP congénita. De estas 64 intervenciones, 21 (33 %) fueron en perros que habían sido sometidos previamente a VPB, 7 (11 %) tenían una anomalía de la arteria coronaria y 21 (33 %) se encontraban en insuficiencia cardiaca congestiva derecha en el momento de la intervención. En esta población, el gradiente de presión medio preoperatorio ecocardiográficamente fue de 134 ± 44 mmHg y el gradiente promedio al día siguiente de la implantación del stent fue de 53 ± 28 mmHg, con una reducción media del 58 %. Estos resultados se comparan favorablemente con la VPB y quizás sean más notables, ya que muchos de estos perros no respondieron a la VPB previa o tenían válvulas displásicas que se consideraron malas candidatas para la VPB5.
Valvuloplastia aórtica con balón
La estenosis subaórtica (ESA) es una de las enfermedades cardiacas congénitas más comunes en los perros. La ESA grave es una condición con un pronóstico a largo plazo pobre, y el manejo de la ESA grave en perros sigue siendo un desafío, ya que las opciones de tratamiento son limitadas. Muchos perros son asintomáticos; sin embargo, los pacientes pueden presentar intolerancia al ejercicio, debilidad en los miembros traseros, síncope, insuficiencia cardiaca congestiva izquierda o enfermedad sistémica secundaria a endocarditis valvular. Las arritmias ventriculares y la muerte súbita, con o sin signos clínicos, son comunes. Las modalidades de tratamiento en la medicina veterinaria han incluido el uso de medicamentos beta – bloqueantes en combinación con la restricción del ejercicio, la dilatación con balón/valvuloplastia de la región estenótica y la resección de la cresta o anillo fibroso mediante cirugía a corazón abierto. La estenosis aórtica valvular es poco común en perros y gatos, aunque se pueden considerar opciones de tratamiento similares.
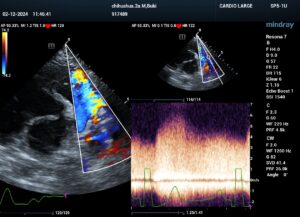
La valvuloplastia aórtica con balón (VAB) se recomienda a perros con estenosis subaórtica o aórtica grave (gradiente de presión del tracto de salida del ventrículo izquierdo mayor de 80 mmHg). Además de la intervención VAB, el tratamiento incluye terapia oral con betabloqueantes y restricción del ejercicio. Idealmente, esta forma de intervención debería realizarse a edad temprana, antes de que ocurran cambios patológicos irreversibles en el miocardio y las arterias coronarias.
Al realizar la dilatación de la estenosis aórtica subaórtica (ESA), se recomienda elegir un balón de dilatación de alta presión y no elástico para aplicar una alta fuerza radial sobre el tejido subaórtico. El uso de una técnica más agresiva de valvuloplastia con balón de corte (VBC) combinada con valvuloplastia con balón de alta presión ofrece un tratamiento alternativo para perros con estenosis subaórtica grave.
El procedimiento se lleva a cabo a través de un introductor colocado en la arteria carotidea derecha. Se avanza con catéter de angiografía hasta el VI donde se realiza la determinación de presiones y la angiografía para evaluar morfología y tamaño del balón. Se debe prestar especial atención a remover todo el aire del catéter antes de introducirlo. La VBC no debe realizarse en perros con estenosis aórtica puramente valvular, pero tiene beneficios teóricos en perros con estenosis subaórtica (SAS). El diámetro del balón cortante se ajusta aproximadamente en una proporción de 1:1 al diámetro de la estrechez subaórtica o la cintura estenótica. El balón cortante se infla rápidamente utilizando un dispositivo de inflación para lograr de manera consistente la presión nominal de 6 atmósferas. Inflar el balón inicialmente por debajo del tracto de salida del ventrículo izquierdo y luego permitir que la contracción empuje el balón parcialmente inflado hacia la lesión estenótica subaórtica ayuda a posicionar el balón cortante dentro de la lesión. El balón cortante generalmente se infla de 2 a 3 veces y se puede posicionar de manera efectiva dentro de la lesión estenótica durante la mayoría de las inflaciones. Una vez realizado, se retira el balón desinflado y se vuelve a medir presiones para valorar el éxito de la intervención.
Las complicaciones asociadas con la VAB en perros con estenosis subaórtica grave incluyen trauma arterial local, arritmias ventriculares o auriculares, bloqueo de rama o bloqueo auriculoventricular, empeoramiento de la regurgitación aórtica, daño agudo y regurgitación de la válvula mitral, perforación ventricular, embolia sistémica o paro cardiaco. Las arritmias ventriculares son comunes durante el procedimiento; sin embargo, un control agresivo de antiarrítmicos durante la VAB previene la taquicardia ventricular hemodinámicamente significativa en la mayoría de los pacientes. La regurgitación aórtica es una complicación potencial inmediata y progresiva; sin embargo, no es una preocupación clínica común si se selecciona el balón adecuado. Se considera un resultado exitoso una reducción en la gravedad de ≥25-50 % sin un aumento notable en la regurgitación aórtica11.
Cierre del conducto arterioso persistente (CAP)
El conducto arterioso persistente (CAP) es un trastorno cardiovascular congénito común que ocurre como resultado del fallo en el desarrollo del músculo liso vascular dentro del conducto arterioso fetal. Su permeabilidad resulta en una sobrecarga de volumen y posterior hipertrofia excéntrica del corazón izquierdo. Las complicaciones incluyen disfunción sistólica, insuficiencia cardiaca congestiva, desarrollo de hipertensión pulmonar tipo I/II, arritmias o incluso en los casos más graves, que se revierta la dirección del flujo. La mayoría de los perros no tratados mueren. Aquellos que sobreviven suelen desarrollar signos clínicos y complicaciones derivadas de su enfermedad cardiaca a una edad relativamente joven.
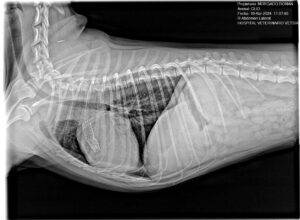
En cuanto al tratamiento, existen distintas opciones. Tradicionalmente, se ha procedido al cierre del CAP mediante cirugía convencional ligando el conducto a través de una toracotomía, procedimiento no exento de mortalidad, complicaciones y la persistencia de flujos residuales. El cierre mediante cirugía intervencionista ha demostrado tener menor mortalidad perioperatoria y un índice menor de complicaciones y un tiempo posoperatorio más corto (imagen 3).
El cierre del CAP mediante intervencionismo consiste en la colocación de un dispositivo en el conducto, que impida el flujo a través de este, guiado por fluoroscopia. Mediante un abordaje por la arteria femoral derecha, se cateteriza la arteria y se coloca un introductor a través del cual se introducirá el material. Utilizando una guía endovascular, se navega a través de la aorta abdominal hasta alcanza la zona del CAP. Mediante angiografía con un catéter específico para ello, se confirma que la localización es correcta y se estudia la morfología y tamaño del CAP. La elección del dispositivo adecuado y del tamaño correcto es crucial para el éxito de la intervención. El dispositivo deberá tener un tamaño de 1,5 a 2,0 veces el diámetro mínimo del conducto (imagen 4).
Con la ayuda de un catéter de liberación, se posiciona el dispositivo quedando la porción distal del dispositivo en la arteria pulmonar mientras que la porción proximal se expande en la ampolla ductal quedando la parte intermedia del mismo en el ostium del CAP. Se realiza de nuevo angiografía para confirmar el correcto posicionamiento y comprobar que no existe flujo a través de este. Si se encuentra colocado de formar correcta, el dispositivo es liberado y se procede a la extracción del material (vídeo 2) (imagen 5).
Vídeo 2
Entre las complicaciones más frecuentes en este tipo de procedimiento podemos encontrar las infecciones, la embolización del dispositivo y hemorragia y/o desgarro de la arteria femoral12.
Hasta hace relativamente poco tiempo, el tamaño de los pacientes era uno de los criterios de exclusión para este tipo de cirugías. Pacientes menores de 2,5 kg con CAP debían someterse a la cirugía convencional debido al tamaño de la femoral. En la actualidad, se han diseñado nuevos dispositivos que permite cerrar el CAP por abordaje yugular con prometedores resultados (imagen 6).
Marcapasos
Las bradiarritmias productoras de síntomas son la principal indicación para la colocación de marcapasos tanto en perros como en gatos. La terapia con marcapasos está indicada en el bloqueo atrio ventricular (AV) de 2º grado avanzado o 3er grado, síndrome del seno enfermo (SSS) / disfunción del nódulo sinusal (DNS) o silencio atrial persistente. Los síntomas que suelen presentar estos pacientes son principalmente síncopes, pero también intolerancia al ejercicio, síncopes parciales o presíncopes, debilidad, ataxia o incluso insuficiencia cardiaca congestiva (ICC).
El tipo de bradiarritmia presente y su origen determinará el tipo de marcapasos que se deberá colocar, la localización del electrodo y la programación y se deberá estudiar cada caso de forma individual.
Los bloqueos AV (BAV) son la indicación más frecuente para la implantación de forma permanente de un marcapasos en perros y gatos. En la mayoría de los perros que se ven afectados por un bloqueo AV (2º grado avanzado o 3er grado), se utilizan marcapasos de una sola cámara en los cuales el electrodo se coloca en el ventrículo derecho (VD) (tabla 2).
Tabla 2. Clasificación de los tipos de marcapasos.
| Posición | I | II | III | IV | V |
| Categoría | Cámara estimulada | Cámara sensada | Respuesta | Modulación de frecuencia | Estimulación multisitio |
| O = ninguno | O = ninguno | O = ninguno | O = ninguno | O = ninguno | |
| A = Atrio | A = Atrio | T = triggered | R = modulación de velocidad | A = Atrio | |
| V = Ventrículo | V = Ventrículo | I = Inhibido | V = Ventrículo | ||
| D = Dual (A+V) | D = Dual (A+V) | D = Dual (T+I) | D = Dual (A+V) |
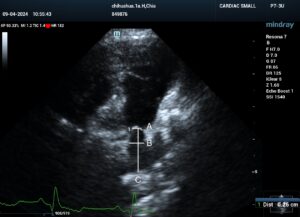
El procedimiento comienza con la cateterización de la vena yugular colocando un introductor como puerto de entrada del material necesario. A través de este introductor, se introduce el electrodo del marcapasos y, guiado por fluoroscopia, se posiciona en la porción más próxima al septo interventricular del ápex del VD. Tras comprobar que se tiene una estimulación consistente y la captura de despolarización ventricular es correcta, se ancla el electrodo al miocardio. Una vez anclado, se realiza un “bolsillo” subcutáneo en la zona del cuello para la colocación del generador. Hasta la implantación de este, suele ser necesaria la utilización de un marcapasos externo durante la cirugía para mayor estabilidad del paciente (imagen 7).
Algunas de las complicaciones descritas en este tipo de intervención serían la formación de seromas, infecciones, tromboembolismo venosos o de trombos alrededor del electrodo, así como la perforación del miocardio.
En el caso de los gatos, se han reportado casos de obstrucción de la vena cava craneal provocando quilotórax en la implantación de marcapasos transvenosos, por lo que la recomendación en estos pacientes es colocar un marcapasos epicardio en el ventrículo izquierdo (VI) por un abordaje abdominal / diafragmático.
La implantación de marcapasos de dos cámaras con dos electrodos, uno situado en el atrio y otro en el ventrículo, proporciona un funcionamiento más fisiológico; sin embargo, debido a que supone un mayor coste, un mayor tiempo de cirugía y el inconveniente del tamaño a la hora de colocar dos electrodos, sobre todo en animales de pequeño tamaño, los hacen poco frecuentes en medicina veterinaria13.
Técnica V- Clamp
Las opciones terapéuticas para la enfermedad degenerativa de la válvula mitral (EDVM) en perros están en su mayoría limitadas al manejo médico. La reparación quirúrgica a corazón abierto de la válvula mitral se realiza en escasos centros en todo el mundo, ya que requiere equipamiento especializado y costoso por la necesidad de circulación extracorpórea.
Debido a esta situación, recientemente se ha desarrollado un nuevo dispositivo llamado V – Clamp. A través de una técnica mixta de mínima invasión se coloca el dispositivo en la válvula mitral para disminuir la regurgitación mitral. Se trata de una técnica novedosa y muy prometedora que se desarrolla en muy pocos centros del mundo14 entre ellos, España.
Conclusiones
La cardiología intervencionista se encuentra en constante desarrollo y aporta soluciones terapéuticas para numerosos procesos patológicos. Se han explicado de forma más profunda las más frecuentes, pero existen otras muchas como, por ejemplo, extracción de filarias, estenosis de las válvulas atrioventruclares, patologías congénitas complejas como comunicaciones interventriculares, cor triatriatum dexter o sinester, ablación de arritmias, septotomías, biopsias endocárdicas, etc.
A pesar de los avances en estos últimos años, queda un gran camino que recorrer, pero se plantea un futuro prometedor y un campo realmente interesante dentro de la cardiología veterinaria.
Bibliografía:
- Scansen BA. Interventional Cardiology: What’s New? Vet Clin North Am Small Anim Pract. 2017 Sep;47(5):1021-1040.
- Schrope DP. Prevalence of congenital heart disease in 76,301 mixed-breed dogs and 57,025 mixed-breed cats. J Vet Cardiol. 2015 Sep;17(3):192-202.
- Oliveira P, Domenech O, Silva J, Vannini S, Bussadori R, Bussadori C. Retrospective review of congenital heart disease in 976 dogs. J Vet Intern Med. 2011 May-Jun;25(3):477-83.
- Bussadori C, DeMadron E, Santilli RA, Borgarelli M. Balloon valvuloplasty in 30 dogs with pulmonic stenosis: effect of valve morphology and annular size on initial and 1-year outcome. J Vet Intern Med. 2001 Nov-Dec;15(6):553-8.
- Scansen BA. Advances in the Treatment of Pulmonary Valve Stenosis. Vet Clin North Am Small Anim Pract. 2023 Nov;53(6):1393-1414.
- Bussadori C, DeMadron E, Santilli RA, et al. Balloon valvuloplasty in 30 dogs with pulmonic stenosis: effect of valve morphology and annular size on initial and 1- year outcome. J Vet Intern Med 2001;15(6):553–8.
- Locatelli C, Domenech O, Silva J, et al. Independent predictors of immediate and long-term results after pulmonary balloon valvuloplasty in dogs. J Vet Cardiol 2011;13(1):21–30.
- McCrindle BW. Independent predictors of long-term results after balloon pulmo- nary valvuloplasty. Valvuloplasty and Angioplasty of Congenital Anomalies (VACA) Registry Investigators. Circulation 1994;89(4):1751–9.
- Belanger C, Gunther-Harrington CT, Nishimura S, et al. High-pressure balloon val- vuloplasty for severe pulmonary valve stenosis: a prospective observational pilot study in 25 dogs. J Vet Cardiol 2018;20(2):115–22.
- Gunasekaran T, Javery E, Sanders RA. Immediate outcomes of low-pressure balloon valvuloplasty for severe pulmonary valve stenosis in 20 dogs: a retro- spective, single-center case series. J Vet Cardiol 2021;36:99–104.
- Kleman ME (2015) Aortic valve stenosis. In: Weisse CBerent A, eds. Veterinary Image-Guided Interventions. John Wiley & Sons Inc, Oxford: 588–94.
- Weisse C, Berent A. Veterinary Image-Guided Interventions. Ames, Iowa: John Wiley & Sons Inc.; 2015: 564–574.
- Estrada, A.H. (2015). Cardiac Pacing. In Veterinary Image-Guided Interventions (eds C. Weisse and A. Berent).
- Potter BM, Orton EC, Scansen BA, Abbott-Johnson KM, Visser LC, Chi IB, Ross ES, Del Nero B, Tantisuwat L, Krause ET, Rezende ML, Mama K. Clinical feasibility study of transcatheter edge-to-edge mitral valve repair in dogs with the canine V-Clamp device. Front Vet Sci. 2024 Dec 9;11:1448828