X.Raurell1, T.M.Basto2
1 Hospital Veterinari Molins – IVC Evidensia
2 Frank Pet Surgeons – IVC Evidensia (Leeds, UK).
Este artículo pretende llevar a cabo un breve repaso de los tumores de plexos coroideos, tanto en el aspecto epidemiológico, diagnóstico como de tratamiento y, además, añadir la experiencia del autor con este tipo de tumores.
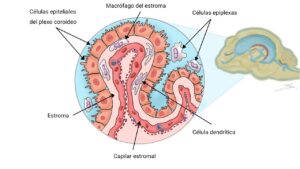
Los plexos coroideos (PPCC) son formaciones que se originan a partir de las células ependimarias modificadas, tienen la función de producción y secreción del líquido cefalorraquídeo (LCR) y se sitúan en el interior de los ventrículos cerebrales (ventrículos laterales, III y IV ventrículo) (imagen 1 – clic para ampliar).
Los tumores de los plexos coroideos (TPC) son el tercer tipo de tumor primario cerebral más frecuente, por detrás de los meningiomas y gliomas. Tienen una incidencia del 0,1-0,2 % en la población canina en general y de entre un 5,7 % y 10 % de las neoplasias primarias intracraneales. Aparte del perro, también pueden verse afectados por este tipo de tumor el gato, el caballo, la cabra y la vaca pero con mucha menor frecuencia. En medicina humana los TPC representan cerca del 3 % de los tumores cerebrales y generalmente se diagnostican en niños menores de 2 años.
Existen diversos tipos de TPC según la clasificación adaptada de la OMS: el papiloma de PPCC (grado 1), el papiloma de PPCC atípico (grado 2) y el carcinoma de PPCC (grado 3) con una incidencia del 36 %, 2 % y 62 %, respectivamente.
Son más frecuentes en el IV ventrículo (46 %) que en el III ventrículo (22-36 %) y que en los ventrículos laterales (18 %).
Tanto los papilomas como los carcinomas pueden presentar metástasis dentro del mismo encéfalo o lejanas medulares (drop metastases) a través del espacio subaracnoideo, dando lugar a implantes intradurales-extramedulares aunque esta presentación es extremadamente inusual (Albertini GM et al.).
La edad de presentación varía entre 3-14 años con un promedio de 6 años. En un artículo reciente (Albertini GM et al.) se describe por primera vez una diseminación intraventricular y medular de un papiloma de plexos coroideos en un Cane Corso de 2 años.
Los perros con papilomas suelen ser más jóvenes (5 años de media) que los que presentan carcinomas de plexos coroideos (7 años de media).
No existe diferencia estadística entre machos y hembras, aunque en algunos artículos se describe cierta predisposición en los machos.
Signos clínicos y neurolocalización
Los pacientes con TPC mostrarán signos neurológicos dependiendo del área del encéfalo afectada y de los efectos del posible aumento de presión intracraneal. Estos pueden ser rostrotentoriales, caudotentoriales o una combinación de ambas localizaciones. La presentación clínica de estos pacientes suele ser crónica y progresiva con una amplia variedad de signos neurológicos como ataxia, hemiparesia, tetraparesia, ladeo de la cabeza, nistagmo, estrabismo posicional, midriasis, dolor cervical, obnubilación, convulsiones y agresividad. También se puede ver en algunos casos incontinencia urinaria y, en un caso de diseminación medular lejana, se observó paraparesia crónica y progresiva sin signos intracraneales (Albertini GM et al.).
Por lo tanto, se puede localizar la lesión a nivel de tronco del encéfalo, sistema vestibular central con síndrome vestibular paradójico en ocasiones, prosencéfalo o también tener una localización multifocal intracraneal. En el caso descrito anteriormente de diseminación medular, la neurolocalización clínica fue en los segmentos medulares T3-L3.
Diagnóstico
Diagnóstico presuntivo
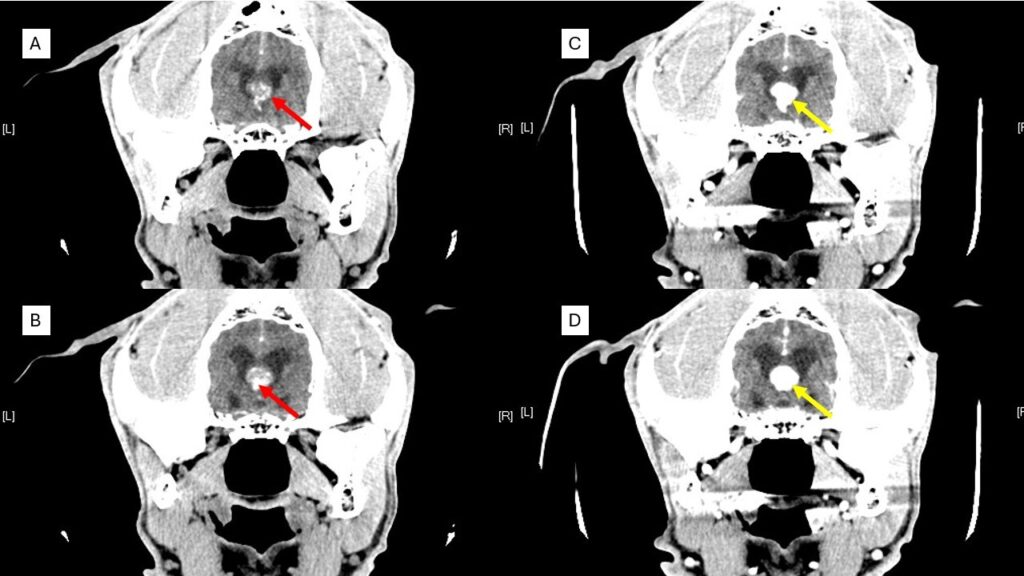
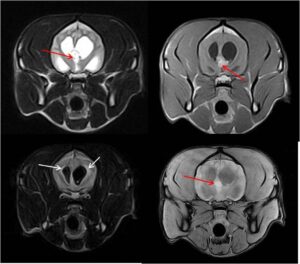
El diagnóstico presuntivo de los TPC se realiza a través de imagen avanzada como tomografía computarizada (TAC) o, idealmente, mediante resonancia magnética (RM). Se sitúan a nivel intraventricular, sobre todo en el IV y III ventrículos. Suelen ser masas con un aspecto papiliforme, lobulado o globular, a veces, heterogéneos en su interior debido a necrosis, mineralización, hemorragias o formación de quistes y, con un fuerte realce poscontraste (imagen 2 – clic para ampliar).
En RM se ven hiperintensos en T2 y FLAIR y, en T1 tienen una intensidad muy variable.
Pueden verse como masas únicas intraventriculares o bien, y en menor frecuencia, como lesiones múltiples a lo largo del sistema ventricular y como implantes en el espacio subaracnoideo en el 35 % de los carcinomas de plexos coroideos.
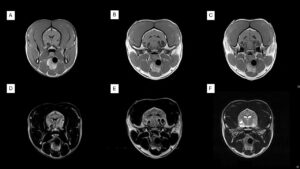
El 75 % de los TPC provocan hidrocefalia secundaria debida al aumento de secreción del LCR o por obstrucción de los agujeros interventriculares si ocurren en el III ventrículo o de las aperturas laterales si ocurren en el IV ventrículo. Asociado a la hidrocefalia hipertensiva también se puede observar edema periventricular (imagen 3 – clic para ampliar).
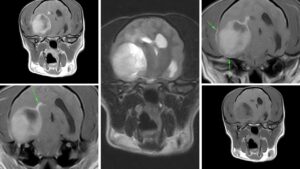
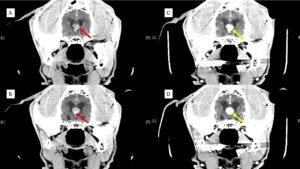
También pueden invadir y desplazar el parénquima cerebral adyacente, con un grave efecto de masa, desplazar al ventrículo lateral e incluso, en contadas ocasiones, se han visto defectos en los huesos del cráneo por probable atrofia debido al aumento sostenido de la presión intracraneal descrito por Hughes JR et al. y en un caso de este autor (imagen 4 – clic para ampliar).
Imagen 4. Resonancia magnética de un Yorkshire Terrier macho de 8 años con convulsiones y déficit en la respuesta de amenaza del ojo izquierdo. Imagen superior izquierda: corte transversal en T1, poscontraste, a la altura del tálamo, en el que se aprecia una masa redondeada, con márgenes definidos y captación de contraste en su interior que, en su aspecto medial, parece tener un componente necrótico y que se sitúa a nivel temporal derecho. También se observa captación de contraste en el interior del ventrículo lateral adyacente. Imagen inferior izquierda: corte transversal en T1, poscontraste, ligeramente caudal a la anterior, en la que se muestra la relación de la masa con el ventrículo lateral ipsolateral (flecha verde). Imagen central: corte transversal en T2 a la altura del tálamo en el que se observa el efecto masa, compresión del ventrículo lateral y desplazamiento del parénquima cerebral adyacente con edema vasogénico del mismo lado en el centrum semiovale. Imagen superior derecha: corte transversal en T1, poscontraste, en el que se muestra la relación de la masa con el ventrículo lateral y la afectación de los tejidos blandos adyacentes (flechas verdes) que en la craniectomía se evidenció como un pequeño defecto óseo en esa área del cráneo. Imagen inferior derecha: corte transversal en T1, previo al contraste, donde se observa el efecto masa, compresión del ventrículo lateral e hipointensidad en la zona medial de la masa, compatible con necrosis o lesión quística asociada. Imágenes cedidas por Xavier Raurell.
Diagnóstico diferencial
El diagnóstico diferencial debe hacerse con otros tumores intraventriculares, como son los ependimomas, oligodendrogliomas, tumores neuroectodérmicos primitivos y neurocitoma central. También pueden confundirse con meningiomas y carcinomas glandulares metastásicos.
Se han descrito tres casos de diseminación intraparenquimatosa y en meninges de carcinomas de plexos coroideos sin evidencia de tumor primario intraventricular (Patnaik AK et al., Lipsitz D et al. y Oura TJ et al.). Estos casos se presentaron como lesiones quísticas diseminadas, hipointensas en T1 e hiperintensas en T2 y, en FLAIR, había supresión de la señal de su interior y edema perilesional (Oura TJ et al.). Dichas lesiones se localizaban en tálamo, colículos, hipocampo en un caso (Oura TJ et al.) y lóbulos temporal y parietal en otro (Lipsitz D et al.). Este autor tuvo un caso similar de un perro mestizo, macho de 9 años, que se presentó con convulsiones, aunque en éste sólo fue una sospecha ya que no se pudo acceder a la necropsia (imagen 5).
El estudio del LCR puede presentar un aumento en la concentración de proteínas y presencia de células neoplásicas características en la citología. Los carcinomas manifiestan mayor índice proteico (27-380 mg/dl; media de 108 mg/dl) que los papilomas (< 80 mg/dl). En la citología se pueden ver células aisladas con un núcleo grande y redondo con un citoplasma abundante y basofílico. También es característico ver dichas células en filas o agrupadas en clusters y, en ocasiones, acompañadas de macrófagos.
Diagnóstico definitivo
El diagnóstico definitivo se obtiene mediante el estudio histopatológico que puede apoyarse en la inmunohistoquímica (IHQ).
La clasificación histopatológica de los TPC en veterinaria es adaptada a partir de la de la OMS, que contempla tres tipos: papiloma de plexos coroideos grado 1, papiloma de plexos coroideos atípico grado 2 y el carcinoma de plexos coroideos grado 3.
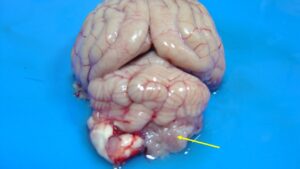
Macroscópicamente, los papilomas tienen un aspecto granular e irregular, bien delimitado y de un color grisáseo o rojizo (imagen 6). Los carcinomas, además, pueden presentar áreas de necrosis y hemorragias y suelen estar más adheridos al parénquima adyacente.
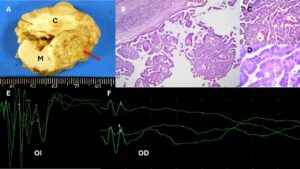
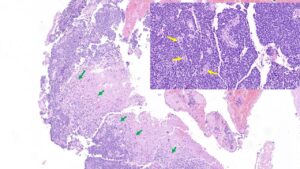
La microscopía presenta un patrón muy característico formado por estructuras ramificadas y papilares con células cuboidales con núcleo redondo a ovoide, formando un epitelio columnar sustentado por un estroma conectivo muy vascular (imágenes 7B, 7C y 7D). A veces, dichas estructuras, pueden formar pseudorrosetas (imagen 8). En los papilomas, el índice mitótico es muy bajo y, en cambio, en los carcinomas este supera las 5 mitosis/10 campos hpf. Además, los carcinomas invaden el parénquima adyacente, pueden presentar hemorragias, necrosis, gliosis moderada y edema de dicho parénquima. En veterinaria el diagnóstico de papiloma atípico grado 2 es muy poco frecuente.
En cuanto a la IHQ de los TPC, se ha descrito inmunorreactividad de estos tumores a la citoqueratinas, E-cadherina, N-cadherina, vimentina, GFAP, Ki67 y Kir 7.1. La N-cadherina ha mostrado más afinidad para los papilomas, en cambio, la Ki67, tiene mayor afinidad para los carcinomas. Tanto en humana como en el perro, la Kir 7.1, tiñe la zona apical de las células de los carcinomas de plexos coroideos, lo que permite diferenciarlos de los carcinomas metastásicos desde fuera del SNC. La vimentina tiñe el estroma de los TPC y la GFAP no muestra ser específica para este tipo de tumor, aunque puede mostrar cierta reactividad.
Imagen 8. Microscopía con H/E del estudio histopatológico del Yorkshire de la imagen 4 después de la craniectomía. Se aprecia un patrón infiltrativo (flechas verdes), denso y sólido, parcialmente papilar, de células cilíndricas con núcleo grande y pleomórfico que, en múltiples áreas, forman pseudorrosetas perivasculares (flechas amarillas). El índice mitótico en este caso era de 12/10 campos hpf. El diagnóstico final fue de carcinoma de plexo coroideo. Imágenes cedidas por Francisco Fernández (Urano).
Tratamiento
Como en todos los tipos de tumores intracraneales, los tumores de plexos coroideos pueden ser tratados mediante tratamiento paliativo, cirugía, quimioterapia o radioterapia, aunque la bibliografía es muy limitada en este caso. Esta clase de tumores presentan la dificultad de su localización intraventricular, lo que puede limitar la opción quirúrgica sobre todo los del III ventrículo.
El tratamiento paliativo consiste en la administración de glucocorticoides (0,5-1 mg/kg/12-24 h) para minimizar el edema vasogénico, antiepilépticos y manitol 20 % (0,5-1 mg/kg).
El tratamiento quirúrgico de los TPC en medicina humana es el de elección y puede continuarse con quimioterapia o radioterapia. En veterinaria el tratamiento quirúrgico de los TPC se limita a unas pocas referencias. Los TPC del IV ventrículo pueden ser extirpados mediante craniectomía suboccipital (Akin EY, Shores A.). Existe un caso de un gato con un tumor intraventricular en el que se accedió al III ventrículo a través del ventrículo lateral mediante craneotomía rostrotentorial izquierda. En este caso el diagnóstico definitivo fue de ependimoma (Simpson DJ et al.). En un artículo reciente se describen tres casos tratados mediante un abordaje parietal, parasagital para acceder al cuerpo calloso y, a través de una pequeña incisión en este, acceder al ventrículo lateral y extirpar el tumor (Lehner L et al.).
El uso de una derivación ventrículo peritoneal (DVP) está descrito en veterinaria en cuatro casos de tumores del III ventrículo en los que los pacientes mostraron un rápido deterioro neurológico debido al aumento de presión intracraneal por la hidrocefalia obstructiva (Orlandi R et al.). Este artículo pone de relevancia que la colocación de una DVP puede ser un tratamiento rápido y eficaz en este tipo de pacientes.
Apenas existen publicaciones con suficiente número de casos de TPC tratados con quimio y radioterapia. En un artículo se describe un caso de un Schnauzer macho de 10 años con un papiloma de plexo coroideo en el IV ventrículo que fue tratado con imatinib e hidroxiurea y, luego, con lomustina e hidroxiurea con un tiempo de supervivencia de 388 días desde el inicio del cuadro clínico (Dong-In Jung et al.). La radioterapia debe considerarse, sobre todo en aquellos casos en los que ha habido una resección quirúrgica parcial y en los casos de carcinomas de plexos.
Pronóstico
Los TPC pueden presentarse de diversas formas y, su pronóstico va a depender de variables como la gravedad de los signos clínicos y su duración hasta el diagnóstico, localización (rostrotentorial frente a caudotentorial), tipo de tumor y grado (papiloma frente a carcinoma), efecto masa, obstrucción del sistema ventricular y consecuente hidrocefalia, metástasis en encéfalo y distantes en médula, tratamientos aplicados, etc.
Al haber tantas variables que pueden modificar el pronóstico y la tasa de supervivencia, es difícil una respuesta estándar. En esta revisión se han encontrado cuatro artículos en los que se describen casos clínicos aislados y dos en los que se describen una serie de tres casos y otra de cuatro casos con TPC. En un total de 10 perros, tres se eutanasiaron después del diagnóstico por imagen, un caso tratado con lomustina e hidroxiurea tuvo una tasa de supervivencia de 388 días desde el inicio de los signos clínicos, dos casos de PPC tratados con cirugía a través del cuerpo calloso sobrevivieron 17 y 41 meses después de la cirugía y, de los cuatro perros tratados con DVP, tres sobrevivieron entre 6-24 meses después de la cirugía y uno permanecía aún vivo 30 meses después de la colocación de la DVP. El caso de la imagen 4, se trató con craniectomía rostrotentorial derecha y lomustina, con lo que se obtuvo una supervivencia posdiagnóstico de 8 meses.