Prieto Muñoz, C.; Sanjuan Aguado, A.; Reinaldos Velasco, N.
AniCura Madrid Este Hospital Veterinario
Imágenes cedidas por los autores
Resumen
El parvovirus canino (CPV) es una enfermedad viral altamente contagiosa que afecta a cachorros o pacientes inmunocomprometidos. El CPV presenta dos formas clínicas: gastroentérica hemorrágica y miocárdica (poco frecuente y letal).
El diagnóstico se basa en la combinación de historia clínica, signos clínicos, hematología, bioquímica, test rápidos (SNAP), PCR y, en algunos casos, puede requerir histopatología post mortem. El tratamiento es multimodal y sintomático, aunque están en estudio nuevas terapias, como inmunoterapia (anticuerpos monoclonales), terapia con factor estimulante de colonias de granulocitos, trasplante de microbiota fecal y ozonoterapia, que pueden mejorar el pronóstico de la enfermedad. No obstante, la clave es la prevención mediante la vacunación.
Introducción
El parvovirus canino (CPV) genera la enfermedad llamada parvovirosis, la causa más común de morbilidad y mortalidad en perros, sobre todo en cachorros.1 Según estudios retrospectivos, su primera aparición data de 1978.2
Este virus afecta a las células que tienen una rápida mitosis, como las células del epitelio de las criptas del intestino delgado, la médula ósea o el tejido linfoide.2 También hay estudios que demuestran la colonización de las células miocárdicas asociada a una infección durante la gestación. Por ello, existen dos formas de presentación: una gastroenteritis hemorrágica y una miocárdica.3
La transmisión es oral, y puede ser directa por contacto con secreciones que contienen partículas virales (saliva, vómitos y/o heces) o indirecta mediante objetos, superficies o fómites (vehículos, superficies mal desinfectadas, etc.). Se han descrito factores predisponentes, como la raza (dóberman, rottweiler, labrador o pastor alemán), parasitosis, enfermedades concomitantes, estrés y un elevado número de animales que convivan en un mismo espacio.2,3
Fisiopatología
El CPV genera alteraciones fisiopatológicas a nivel sistémico, por su replicación tanto en los órganos ya mencionados (el epitelio de las criptas, la médula ósea y el tejido linfoide), como en el epitelio de la lengua, el bazo, el hígado, los pulmones y los riñones.2
Una vez entra al organismo, el virus se replicará en primer lugar en la lengua y a continuación en las criptas intestinales generando isquemia, daño tisular e inflamación que alterará la composición y función de la microbiota intestinal. Esto producirá un aplanamiento de las vellosidades y necrosis del epitelio, ocasionando una exposición de la lámina propia que generará una gastroenteritis hemorrágica. Todo ello desencadena una malabsorción intestinal y una vía de entrada del virus para su replicación en diferentes órganos, así como de las bacterias al torrente sanguíneo que puede generar una infección sistémica.4,5
Signos clínicos y diagnóstico
La forma gastroentérica hemorrágica afecta a perros de entre 6 y 20 semanas (el 85 % tienen menos de un año)2. Los signos clínicos más comunes son vómitos, diarreas profusas hemorrágicas, fiebre, anorexia y letargia. El diagnóstico se basa en el conjunto de la historia clínica (vacunaciones recibidas), signos clínicos y pruebas laboratoriales.2,3
El diagnóstico laboratorial se centra en hematología, bioquímica, test de inmunoensayo enzimático rápido (SNAP) y/o PCR.2,3
En la hematología se puede observar leucopenia (<100-200 K/uL) con linfopenia por la destrucción de los precursores de la médula ósea y, en casos más graves, neutropenia con cambios tóxicos por la diseminación bacteriana sistémica.1,2 En función de las pérdidas digestivas hemorrágicas se podrá visualizar una anemia grave.3 Todo ello dependerá de la respuesta de la inmunidad innata y adaptativa de cada individuo ante la inflamación sistémica generada por la infección.2
A nivel bioquímico se ha valorado la importancia de la medición del calcio y el magnesio en relación con el pronóstico. La hipocalcemia ionizada es una alteración electrolítica que aparece en el 16-24 % de los perros con CPV asociada a hipoalbuminemia por las pérdidas digestivas, como proteína de fase negativa o por su relación con el magnesio. En estudios recientes se ha valorado que los pacientes con alteraciones del calcio (hipocalcemia o hipercalcemia) tienen más probabilidad de fallecer que los normocalcémicos. Entre las causas de hipercalcemia destaca el daño renal debido a la disfunción orgánica, de manera que puede ser difícil de valorar en cachorros la funcionalidad renal, puesto que presentan valores de creatinina y urea bajos de forma fisiológica, aunque podría también estar asociado a sepsis y a una fluidoterapia agresiva.6
Respecto a las pruebas laboratoriales de detección de antígeno, se pueden realizar en muestras de heces, células de la orofaringe y sangre.2 El diagnóstico en heces se puede realizar mediante ELISA que detecta antígenos fecales, una prueba que, según el laboratorio de referencia, tiene una elevada sensibilidad (100 %, intervalo de confianza 95 %) y especificidad (100 %, intervalo de confianza 95 %) por lo que puede no requerir otras pruebas adicionales.7 Sin embargo, en la práctica clínica se ha visto que la sensibilidad puede no ser del 100 %, ya que se han obtenido falsos negativos en paciente con una infección temprana, dilución o consistencia de las heces, baja carga viral, eliminación intermitente e interferencia con vacunas vivas (no interfiere en vacunas modificadas).2,7 Existen otras pruebas para su confirmación en pacientes con alta sospecha y test rápido negativo, como reacción en cadena de la polimerasa (PCR), inoculación de cultivos celulares y microscopio electrónico. La técnica de referencia es mediante serología con una inhibición de la hemaglutinación (HAI), aunque solo está disponible en laboratorios especiales.2
Una prueba habitual en la clínica diaria es la ecografía abdominal, donde se observan hallazgos inespecíficos como la distensión del tracto digestivo con contenido gaseoso y líquido, íleo paralítico con moteado hiperecogénico en el duodeno y presencia de escaso líquido libre anecoico.2
Tratamientos convencionales
El manejo terapéutico de la parvovirosis gastroentérica está basado en la instauración de un tratamiento sintomático y para las complicaciones asociadas.
Fluidoterapia
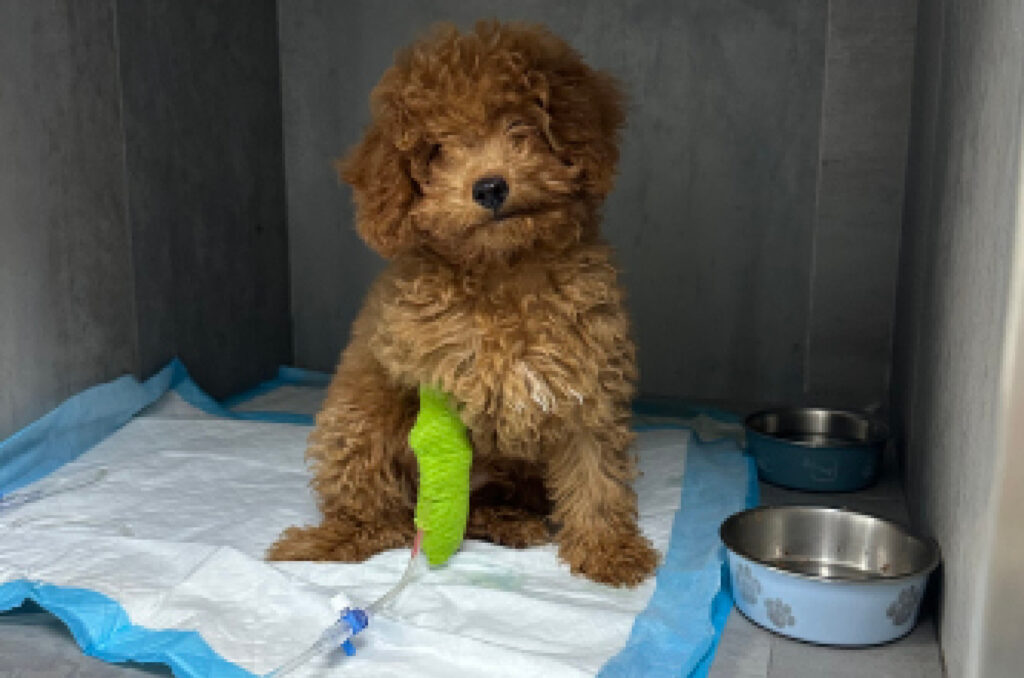
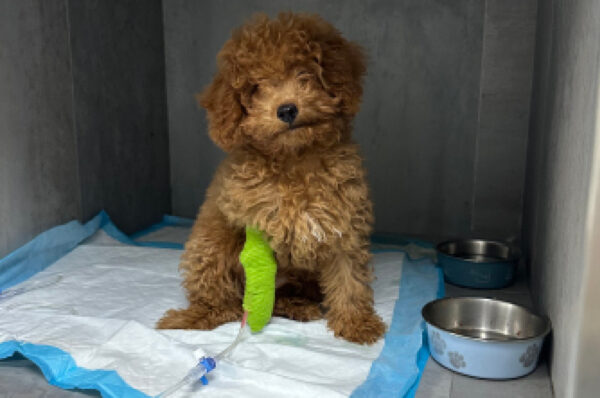
La fluidoterapia mediante un acceso venoso permite restaurar el volumen intravascular, reponer las pérdidas de líquido intersticial y mantener la hidratación. Se debe realizar con fluidos cristaloides isotónicos en función de la deshidratación del paciente y/o hipovolemia. En pacientes con hipoglucemia se ha de suplementar la fluidoterapia con glucosa en función de sus necesidades2 (imagen 1).
Antibioterapia
Los pacientes con parvovirosis tienen predisposición a la traslocación bacteriana por el daño generado en las criptas mencionado anteriormente. En pacientes con neutropenia o riesgo de sepsis se debe administrar antibioterapia de amplio espectro (ampicilina, cefazolina, metronidazol o enrofloxacino) de manera responsable. Los antibióticos se deben retirar tras la resolución de los signos clínicos o la leucopenia, ya que pueden generar alteraciones de la microbiota.2,8
Antieméticos
Este tipo de medicamentos minimizan la pérdida de líquidos y, por tanto, la deshidratación del paciente, así como la alimentación oral temprana.9
Los antieméticos más utilizados son el maropitant, la metoclopramida y el ondansetron.9,10 Diversos estudios demuestran que el uso de los medicamentos reduce la gravedad de los vómitos desde el primer día de aplicación y la cantidad desde el tercer día, pero no se ha observado ninguna superioridad de un fármaco frente a otro:9
- El maropitant es un antagonista de los receptores de neuroquinina 1, que se encuentra a nivel del sistema nervioso central (lo que supone su principal ventaja). Su uso debe ser limitado en perros menores de 8 semanas por su moderado efecto supresor de la médula ósea.9
- La metoclopramida es un antagonista dopaminérgico que ejerce un efecto procinético en el tracto intestinal superior, aunque se debería evitar el uso en pacientes con riesgo de invaginación. Se puede administrar cada ocho horas o mediante infusión continua en casos graves.9,10
- El ondasetron es un antagonista de los receptores de la serotonina que se utiliza cuando no se obtiene la respuesta deseada con los dos fármacos anteriores.9 Debido a que su vía de administración es intravenosa, su uso es limitado (aunque también existen formas que se administran por vía oral).10
También se ha descrito el uso de la eritromicina, un antibiótico macrólido que aumenta la motilidad gastrointestinal debido a la estimulación de los receptores de motilina. Estos receptores producen contracciones en el antro gástrico, duodeno y yeyuno, de manera que se acelera el vaciado gástrico sin evidencia a nivel del colon (dosis: 0,5-1 mg/kg IV cada 8 horas). En medicina humana se recomienda el uso de este fármaco como tratamiento procinético de primera línea. Debido al problema de resistencias a antimicrobianos al que nos enfrentamos a nivel global, el uso de este fármaco debe guiarse por la suma de criterio clínico y ausencia de respuesta a la utilización de los fármacos anteriormente descritos, ya que aún necesita evidencia prospectiva para confirmar su seguridad y eficacia.11,12
Soporte oncótico
Tal y como se ha comentado anteriormente, los pacientes pueden presentar hipoalbuminemia debido a las pérdidas gastrointestinales y a la anorexia. La albúmina ejerce un papel fundamental en el mantenimiento de la presión oncótica, la eliminación de radicales libres y el transporte de fármacos; por ello, es crucial su monitorización.2
Esta reposición se puede realizar mediante plasma fresco, plasma fresco congelado, concentrados de albúmina, plasma inmune hiperinmune (HIP) o coloides sintéticos.2,10,13,14 Las evidencias más recientes sugieren que el plasma fresco congelado y los concentrados de albúmina son las opciones más recomendadas debido a sus múltiples ventajas, como proporcionar proteínas plasmáticas, factores de coagulación y anticuerpos antivirales.14 No obstante, existen controversias, por lo que la toma de decisiones dependerá de cada caso clínico.
Nutrición enteral
La nutrición es clave y esencial para prevenir la atrofia de los enterocitos, promover el crecimiento de la microbiota, proporcionar los nutrientes necesarios y reducir la morbilidad con un inicio temprano.2,3 Las necesidades energéticas se calcularán en función del gasto energético, comenzando por un 25 % en varias tomas o en infusión continua (CRI) hasta el total, cuando exista una buena tolerancia durante su ingreso3 (imágenes 2 y 3).
Imágenes 2 y 3. Dos pacientes alimentados mediante sonda nasogástrica.
Analgesia
Estos pacientes pueden presentar dolor por los vómitos, íleo paralítico y/o posibles intususcepciones. Los analgésicos opioides puros, como el fentanilo o la metadona, pueden favorecer los signos clínicos anteriormente descritos, por lo que se opta por opioides agonistas parciales, como la buprenorfina. Otra opción segura es la lidocaína en CRI, ya que también puede promover la motilidad, y/o maropitant, que proporciona analgesia visceral, además de ser un antiemético central.2
Nuevas terapias
Antivirales
Los interferones como el interferón humano, el interferón omega felino recombinante, el oseltamivir y el famciclovir tienen efectos antivirales, antiproliferativos e inmunomodulares.1
El interferón omega felino recombinante (FeIFN-ω) (dosis: 1–5× 106 UI/kg/IV/SID durante 3 días) tiene efectos beneficiosos en la disminución de signos clínicos (fiebre, vómitos y diarreas), mejora el apetito y se relaciona con una reducción de la mortalidad.1,2 Varios estudios demuestran la eficacia de este interferón en perros, aunque puede presentar efectos secundarios transitorios y leves como letargo temporal, fiebre transitoria, cambios gastrointestinales (heces blandas o diarreas leves y vómitos ocasionales) y alteraciones hematológicas, como leucopenia transitoria.15,16
El oseltamivir (OSEL) (dosis: 2 mg/kg/VO/BID durante 5 días) es un antiviral que según los últimos estudios reduce la permeabilidad bacteriana y, por tanto, el riesgo de la translocación bacteriana, aunque no tiene influencia en la morbilidad, mortalidad o duración de la hospitalización.1,2,10
El famciclovir (dosis: 40 mg/kg/VO/BID durante 5 días) es un antiviral utilizado en la rinotraqueitis felina causada por herpesvirus. En perros hay escasos estudios que indican que se puede utilizar en pacientes con parvovirus debido a su seguridad metabólica y farmacocinética.1,2
Plasma inmunitario
El plasma inmunitario es un plasma sanguíneo que contiene altos valores de anticuerpos frente al parvovirus canino, sobre todo inmunoglobulina G (IgG). Se obtiene de perros vacunados o que han superado la infección y, por tanto, su respuesta inmunológica es sólida.17
Sin embargo, ante la necesidad de un tratamiento más específico, se ha desarrollado un anticuerpo monoclonal contra el parvovirus canino (CPMA).14,17 Los estudios demuestran que el CPMA se une al parvovirus neutralizando su capacidad para unirse y replicarse en las células y, por tanto, disminuye la infección, aumenta la albúmina y los factores de coagulación.2
Los resultados sobre su eficacia clínica en diferentes estudios son dispares. Varios estudios retrospectivos en los que se administró una única dosis de 12 mL de plasma inmunitario obtenido de perros que sobrevivieron de forma natural a la enfermedad no lograron mejorar la leucopenia, reducir la viremia ni el periodo de hospitalización; pero, por el contrario, la administración de IgG liofilizada contra el parvovirus sí mostró una disminución de los síntomas y del tiempo de hospitalización.2
El Comité Institucional de Cuidado y Uso de Animales (IACUC) aprobó un estudio de infección experimental con administración temprana de anticuerpos CPMA (0,2 mL/kg) que sí ha demostrado reducir los signos clínicos y ofrecer protección frente a la mortalidad; esta opción se considera esencial para el manejo de la enfermedad.15
Factor estimulante de colonias de granulocitos (g-csf)
El G-CSF es una glicoproteína que estimula la producción, diferenciación y activación de los granulocitos, especialmente los neutrófilos. El uso de este factor puede ayudar a aumentar el número de neutrófilos en casos de neutropenia, mejorando la respuesta inmunitaria y reduciendo la duración y gravedad de la parvovirosis.2,18
Se han investigado tanto el factor estimulante humano (hG-CSF) como el canino (cG-CSF) para promover la estimulación de la médula ósea y la liberación de los neutrófilos. En algunos artículos no se ha evidenciado mejoría de la neutropenia mediante el uso del hG-CSF, mientras que otros dos estudios han evidenciado que el cG-CSF, en una dosis de 5 mg/Kg/SID, es efectivo para mejorar el número de neutrófilos y el recuento total de leucocitos, aunque no está relacionado con una mayor supervivencia de los pacientes.18–20 Como efecto adverso, el uso del G-CSF al estimular la proliferación celular podría favorecer la multiplicación del virus.3,18
Trasplante de microbiota fecal (FMT)
La microbiota es la encargada de la nutrición de los enteritos actuando como barrera protectora, regulación inmunitaria y mejorando la motilidad gastrointestinal.2 Los métodos más comunes para restaurarla son la administración de probióticos, prebióticos, simbióticos y trasplante de microbiota fecal (FMT). Los estudios sobre el impacto de prebióticos en la microbiota intestinal son escasos mientras que los probióticos tienen un efecto beneficioso en la mejoría de los signos clínicos y mayor recuento de leucocitos al usar varias cepas de Lactobacilli y bifidobacterias.1
La FMT consiste en trasplantar material fecal de un donante sano completamente vacunado y desparasitado (para minimizar el riesgo de transmitir enfermedades infecciosas) al tracto gastrointestinal de un receptor mediante enema rectal y/o cápsulas orales.1,8,21 Esta materia contiene bacterias comensales, virus, hongos, metabólicos bacterianos, inmunoglobulina A (IgA), proteínas muníficas y células epiteliales intestinales (CEI). La IgA protege las células intestinales contra patógenos y toxinas. Además, el FMT aumenta la cantidad de proteobacterias (bacterias productoras de ácidos grasos de cadena corta) y disminuye las bacteroidetes (cuyo aumento puede producir disbiosis intestinal, aunque no sean perjudiciales per se), ya que las bacterias comensales del donante compiten con los patógenos e inhiben el crecimiento de estos en el intestino del huésped.21
La preparación de la FMT se realiza con 10 gramos diluidos en 10 mL de NaCl 0,9 % y se administra mediante un catéter urinario por vía rectal. Se recomienda mantener al animal en decúbito lateral durante unos minutos con la pelvis ligeramente elevada para favorecer la difusión del contenido gracias a la gravedad8,21 (imagen 4).

Varios estudios demuestran estancias hospitalarias más cortas tras la administración de FMT en pacientes con CPV y con diarrea hemorrágica aguda (AHDS) cada 48 horas hasta la resolución de las diarreas o durante cinco aplicaciones.8,21 Los estudios demuestran que la TMF es segura, ya que los animales no presentaron efectos adversos durante ni después del transplante.8 Aunque los estudios sobre su mecanismo de acción y eficacia son escasos y se desconocen, se considera que el éxito está relacionado con la reconstitución de la microbiota intestinal y sus metabolitos correspondientes, reduciendo la disbiosis bacteriana causada por la inflamación, hipermotilidad y cambios en la osmolaridad y el pH.1,2,8
Terapia de ozono
Otra opción novedosa en estudio es la terapia con ozono, un tratamiento económico con propiedades bactericidas, fungicidas y antivirales que impulsan la oxigenación y regeneración tisular. La eficacia de esta terapia se basa en el estrés oxidativo controlado y moderado que produce el ozono activando el factor nuclear eritroide 2 que induce la transcripción de elementos de respuesta antioxidante y, por tanto, la producción de enzimas oxidantes. Se realizó un estudio con un protocolo de tratamiento con fluidoterapia Ringer Lactato ozonizada con el objetivo de mejorar la clínica y reducir el tiempo de hospitalización. En el estudio se observó que la sintomatología de la diarrea se redujo en aquellos animales con el tratamiento con ozono en comparación con aquellos animales no tratados con esta terapia.5
Estas nuevas terapias adyuvantes abren nuevas posibilidades terapéuticas para reducir la mortalidad en una enfermedad letal. Sin embargo, la prevención mediante vacunación sigue siendo la herramienta más efectiva para controlar la enfermedad.
Referencias:
- Ulas N, Ozkanlar Y, Ozkanlar S, Timurkan MO, Aydin H. Clinical and inflammatory response to antiviral treatments in dogs with parvoviral enteritis. J Vet Sci. 2024;25(1):e11.
- Mazzaferro EM. Update on canine parvoviral enteritis. Vet Clin North Am Small Anim Pract. 2025 May;55(3):405-25.
- Mylonakis M, Kalli I, Rallis T. Canine parvoviral enteritis: an update on the clinical diagnosis, treatment, and prevention. Vet Med Res Rep. 2016 Jul;7:91-100.
- Werner M, Vigani A. The microbiome in critical illness. Adv Small Anim Care. 2023 Nov;4(1):101-12.
- Santos TGD, Orlandin JR, Almeida MFD, Scassiotti RF, Oliveira VC, Santos SIP, et al. Ozone therapy: protocol for treating canine parvovirus infection. Braz J Vet Med. 2023;45:e004622.
- Mouton A, Celliers A, Thompson PN, Mellanby RJ, Schoeman JP. Calcium and magnesium abnormalities in puppies with parvoviral enteritis. Am J Vet Res. 2025 Jan 1;86(1):ajvr.24.07.0187.
- Decaro N, Buonavoglia C. Canine parvovirus post-vaccination shedding: Interference with diagnostic assays and correlation with host immune status. Vet J. marzo de 2017;221:23-4.
- Pereira GQ, Gomes LA, Santos IS, Alfieri AF, Weese JS, Costa MC. Fecal microbiota transplantation in puppies with canine parvovirus infection. J Vet Intern Med. 2018 Mar;32(2):707-11.
- Yalcin E, Keser GO. Comparative efficacy of metoclopramide, ondansetron and maropitant in preventing parvoviral enteritis-induced emesis in dogs. J Vet Pharmacol Ther. 2017 Dec;40(6):599-60.
- Sykes JE. Canine parvovirus infections and other viral enteritides. En: Sykes JE, editor. Canine and feline infectious diseases. St. Louis: Elsevier Saunders; 2014. p. 141-51.
- Chiba M, Thomforde GM, Kost LJ, Allen ML, Phillips SF. Motilides accelerate regional gastrointestinal transit in the dog. Aliment Pharmacol Ther. 2000 Jul;14(7):955-60.
- Teo EF, Sharp CR, Boyd CJ, Chee W. Use of erythromycin and metoclopramide in hospitalized dogs: a multicenter historical cohort study. Front Vet Sci. 2025 Apr 25;12:1551312.
- Acciacca RA, Sullivan LA, Webb TL, Johnson V, Dow SW. Clinical evaluation of hyperimmune plasma for treatment of dogs with naturally occurring parvoviral enteritis. J Vet Emerg Crit Care. 2020 Sep;30(5):525-33.
- Sirabian E, Walton RA, Blong AE. A retrospective report on xenotransfusion of canine serum albumin in five critically ill cats. Front Vet Sci. 2025 Jun 5;12:1585988.
- Minagawa T, Ishiwata K, Kajimoto T. Feline interferon-omega treatment on canine parvovirus infection. Vet Microbiol.1999 Sep 1;69(1-2):51-3.
- Ishiwata K, Minagawa T, Kajimoto T. Clinical effects of the recombinant feline interferon-ω on experimental parvovirus infection in Beagle dogs. J Vet Med Sci. 1998 Aug;60(8):911-7.
- Larson L, Miller L, Margiasso M, Piontkowski M, Tremblay D, Dykstra S, et al. Early administration of canine parvovirus monoclonal antibody prevented mortality after experimental challenge. J Am Vet Med Assoc. 2024 Apr 1;262(4):506-12.
- Cohn LA, Rewerts JM, McCaw D, Boon GD, Wagner-Mann C, Lothrop CD. Plasma granulocyte colony-stimulating factor concentrations in neutropenic, parvoviral enteritis-infected puppies. J Vet Intern Med. 1999;13(6):581-6.
- Mischke R, Barth T, Wohlsein P, Rohn K, Nolte I. Effect of recombinant human granulocyte colony-stimulating factor (rhG-CSF) on leukocyte count and survival rate of dogs with parvoviral enteritis. Res Vet Sci. 2001 Jun;70(3):221-5.
- Armenise A, Trerotoli P, Cirone F, De Nitto A, De Sario C, Bertazzolo W, et al. Use of recombinant canine granulocyte-colony stimulating factor to increase leukocyte count in dogs naturally infected by canine parvovirus. Vet Microbiol. 2019 Apr;231:177-82.
- Li K, Yang J, Zhou X, Wang H, Ren Y, Huang Y, et al. The mechanism of important components in canine fecal microbiota transplantation. Vet Sci. 2022 Dec 14;9(12):695.